题目内容
17.下列叙述都涉及化学相关知识,其中正确的是( )| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| B. | 10 g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| C. | 200 ml1mol/LFe2(SO4 )3溶液中,Fe3+和SO42-离子数的总和是NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
分析 A、向FeCl3溶液中通足量Cl2后,可除去FeCl3溶液中的FeCl2杂质,但不能煮沸,煮沸会导致FeCl3水解;
B、乙醇水溶液中溶剂水中含有氢原子,依据乙醇和溶剂水中所含氢原子计算判断;
C、Fe3+水解,则铁离子的数目减少;
D、活泼金属采用电解其熔融盐或氧化物的方法冶炼.
解答 解:A、除去FeCl3溶液中混有的少量FeCl2,溶液中通入足量 Cl2后,反应为;2FeCl2+Cl2=2FeCl3,但不能煮沸,煮沸会导致FeCl3水解,最终生成氢氧化铁沉淀,得不到纯净的FeCl3溶液,故A错误;
B、10g46%的乙醇水溶液中所含氢原子数目=($\frac{10g×46%}{46g/mol}×6+\frac{10g×54%}{18mol/L}×2$)×NA=1.2NA,故B正确;
C、200mL1mol/LFe2(SO4)3溶液中溶质为0.2mol,含阴阳离子物质的量=0.2mol×2+0.2mol×3=1mol,因Fe3+水解,则铁离子的数目减少,则Fe3+和SO42-离子数的总和小于NA,故C错误;
D、Mg是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,如果电解氯化镁溶液,阴极上氢离子放电而不是镁离子反应,所以得不到Mg单质,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是除杂方法分析,溶液中微粒的计算应用,注意盐类水解和电解原理的判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
8.已知C-C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是( )
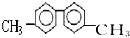

| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
12.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: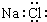 |
2.向含有n gHNO3的稀硝酸中加入m g铁粉,充分反应后铁粉、硝酸均无剩余.若HNO3只被还原为NO,则n:m不可能的为( )
| A. | 3:1 | B. | 5:1 | C. | 4:1 | D. | 9:2 |
9.下列金属中,按照金属性从弱到强的顺序排列的是( )
| A. | 铝、镁、钠、钾 | B. | 镁、铝、钾、钠 | C. | 钙、钾、铷、钠 | D. | 钙、钾、钠、锂 |
6.下列溶液:①石灰水,②H2S溶液,③KMnO4溶液,④氯水,⑤品红溶液.能够区别SO2和CO2气体的是( )
| A. | ①②③ | B. | 只有②③④ | C. | ②③④⑤ | D. | 全部都行 |
7.下列各离子组,由于生成沉淀而不能大量共存的是( )
| A. | NH4+、Fe3+、SO42-、SCN- | B. | Na+、Mg2+、NO3-、OH- | ||
| C. | K+、H+、Cl-、OH- | D. | K+、H+、NO3-、CO32- |

