题目内容
8.如图是某有机物分子的比例模型,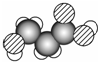 有关该物质的推断正确的是( )
有关该物质的推断正确的是( )| A. | 分子中可能含有羟基 | B. | 分子中可能含有酯基 | ||
| C. | 分子中可能含有醛基 | D. | 该物质的分子式可能为C3H4O3 |
分析 比例模型可以直观地表示分子的形状,其碳原子的成键情况是确定分子结构的关键,碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>O>H.
解答 解:由有机物分子的比例模型 ,可知其结构简式为,
,可知其结构简式为,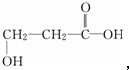 ,分子中含-COOH和-OH,
,分子中含-COOH和-OH,
A、依据分析可知,该有机物分子中含有羟基,故A正确;
B、依据分析可知,该有机物分子中无酯基,故B错误;
C、依据分析可知,该有机物分子中无醛基,故C错误;
D、该有机物的分子式为C3H6O3,故D错误,
故选A.
点评 本题考查有机物分子的比例模型,学生利用模型得出有机物的结构简式时解答本题的关键,明确模型中不同小球代表的原子及成键来分析解答即可.

练习册系列答案
 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
13.下列各氢化物中,稳定性按由强到弱的顺序排列的是( )
| A. | HBr>HF>HCl | B. | HCl>HF>HBr | C. | HF>HCl>HBr | D. | HCl>HBr>HF |
20. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)常温下5% H2O2在FeCl3溶液的催化作用下发生反应的化学方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O↑+O2↑.
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
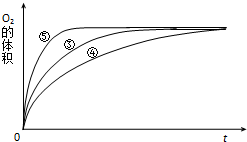
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
17.下列反应既是加成反应又可看作还原反应的是( )
| A. | 乙烯与水反应生成乙醇 | B. | 苯转化为环己烷 | ||
| C. | 乙醇转化为乙醛 | D. | 乙醛转化为乙酸 |
18.已知A、B两元素的原子序数,其中可形成AB2型共价化合物的是( )
①6和16 ②12和17 ③20和9 ④7和8.
①6和16 ②12和17 ③20和9 ④7和8.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
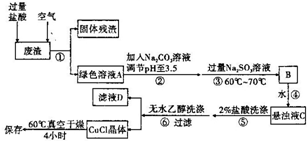 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.