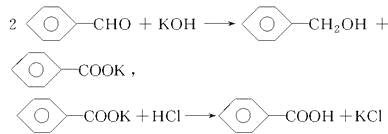
题目内容
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃煤烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H 1
5N2(g)+6H2O(g) △H 1
b.4NH3(g)+5O2(g) ![]() 4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
c.N2(g)+O2(g) ![]() 2NO(g)△H 3=+175kJ·mol-1
2NO(g)△H 3=+175kJ·mol-1
则△H 1=_____kJ/mol。
(2)向某恒容密闭容器中加入2molNH3、3molNO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图所示:
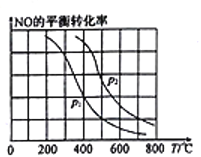
①p1________p2(填“>”“<”或“=”)。
②若在压强为加p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_______________________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是______。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c. NH3、NO生成速率比为5:4 d.容器的总压强保持不变
(3)将2molN2、3molH2O、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图所示。
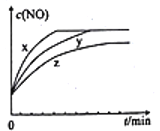
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是_____________________。
【答案】 -1800 > 33.3% ad x>y>z 降低温度。z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低
【解析】(1)由盖斯定律可知,b—5c得反应a,则△H1=△H2—5△H3=-925kJ·mol-1—5×(+175kJ·mol-1)=-1800 kJ·mol-1;
(2)(2)①反应是气体体积增大的反应,增大压强,平衡逆向移动,当温度相同时, P2条件下NO的平衡转化率大于p1条件下NO的平衡转化率,故p1> P2;②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,根据反应4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H1=-1800kJ.mol-1可知,反应消耗1 molNO ,则NO的转化率为
5N2(g)+6H2O(g) △H1=-1800kJ.mol-1可知,反应消耗1 molNO ,则NO的转化率为![]() =33.3% ;③a.水3mol与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态, a正确;b .反应在恒容容器中进行,参与的反应物均为体,混合气体的密度始终保持不变,平衡不一定达平衡,b错误; c. NH3、 N2生成速率比为5:4与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,c错误; d .反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态, d正确。答案选ad ;
=33.3% ;③a.水3mol与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态, a正确;b .反应在恒容容器中进行,参与的反应物均为体,混合气体的密度始终保持不变,平衡不一定达平衡,b错误; c. NH3、 N2生成速率比为5:4与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,c错误; d .反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态, d正确。答案选ad ;
(3)①根据先拐先平"原则,在建立平衡的过程中,三个容器中反应速率的相对大小为x>y>z ;②该反应正反应为放热反应,降低温度平衡正向移动,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低,故与y容器中反应相比,z容器中反应改变的条件及判断依据分别是降低温度。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案