题目内容
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
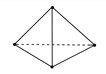
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
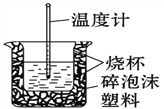
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
【答案】 EF A E CD -882 环形玻璃搅拌棒 保温隔热,防止热量散失 偏小
【解析】一般来说,活泼金属元素与非金属元素形成离子键,非金属元素之间形成共价键,(1)分子晶体熔化不破坏化学键,即EF中熔化不破坏化学键,原子晶体熔化破坏共价键,则A熔化破坏共价键,一般来说,原子晶体熔点最高,分子晶体熔点较低,E的相对分子质量小于F,则E的熔点最低;离子晶体中一定存在离子键,C、D中非金属元素之间形成共价键;(2)由题意知,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,则1 mol N4生成N2的反应为: N4(g)=2N2(g),反应热等于反应物的总键能减去生成物的总键能,故反应热△H=6×167kJ/mo l -2×942kJ/mol =-882kJ/mol;(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;烧杯间填满碎泡沫塑料的作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小。