题目内容
【题目】如图是苯和溴的取代反应的实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:
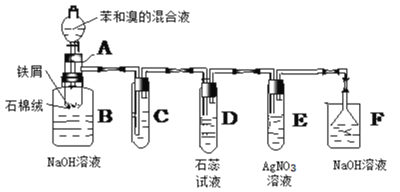
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中发生有机反应的化学方程式(有机物写结构简式)___;反应类型___。
(2)试管C中应盛放的物质是___。
(3)反应开始后,观察试管D、E的现象分别是__;__。
(4)图中哪些装置可以防倒吸?___。
【答案】![]() +Br2
+Br2![]() +HBr 取代反应 苯或者CCl4 溶液变红 产生淡黄色沉淀 DEF
+HBr 取代反应 苯或者CCl4 溶液变红 产生淡黄色沉淀 DEF
【解析】
制取溴苯时,Fe和溴发生反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,溴苯密度较大,B中氢氧化钠能吸收未反应的溴;溴具有挥发性,所以生成的HBr中含有溴,挥发出来溴将影响D、E装置的实验现象,故必须将HBr的Br2除去,利用其极易溶于苯和CCl4的性质,所以C试剂是苯或者CCl4;溴化氢溶于水生成氢溴酸,溶液呈酸性,能使石蕊试液变红色;HBr和硝酸银反应生成淡黄色AgBr沉淀,未反应的溴和溴化氢不能排空,应该用氢氧化钠吸收。
(1)在溴化铁作催化剂条件下苯和溴发生取代反应生成溴苯和HBr,反应方程式为![]() ,该反应是取代反应,故答案为:
,该反应是取代反应,故答案为:![]() ;取代反应;
;取代反应;
(2)挥发出来溴将影响D、E装置的实验现象,故必须将HBr的Br2除去,利用其极易溶于苯和CCl4的性质,所以C试剂是苯或者CCl4,故答案为:苯或者CCl4;
(3)氢溴酸的水溶液呈酸性,能使石蕊试液红色,所以看到D中溶液变红色;溴化氢能和硝酸银反应生成淡黄色沉淀,所以看到E中出现淡黄色沉淀,故答案为:溶液变红色;产生淡黄色沉淀;
(4)D、E、F均可能有极易溶于水的HBr通过,必须防倒吸,D、E中导管未插入溶液中,F中倒扣的漏斗均能起到防倒吸的作用,故答案为:DEF。

【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_____(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:

①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和 (b)。

图(a)中能量主要转化方式为____,图(b)中发生反应的化学方程式为_____。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。

图中第______min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是______;达到平衡时氢气的浓度为______。
(4)已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能,反应H2(g)+ I2(g)=2HI(g)相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的△H为_________kJ·mol-1。
(5)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_________(不定项选择)。
a.反应速率v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如下图所示,图中v(正)与v(逆)相等的点为______(选填字母)。
【题目】已知:2H2(g)+O2(g)=2H2O(g)反应放出的热量为483.6 kJ。有关键能数据如表所示:则水分子中O—H键键能为( )
化学键 | H-H | O=O |
键能/(kJ·mol-1) | 436 | 498 |
A.463.4 kJ·mol-1B.926.8 kJ·mol-1C.221.6 kJ·mol-1D.413 kJ·mol-1