题目内容
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
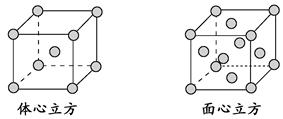
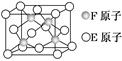
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH。
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
(1)Cu+的核外电子排布式为 。
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO
 OHC-CH2CH2OH。
OHC-CH2CH2OH。OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
(1)[Ar]3d10或1s22s22p63s23p63d10(2分);
(2)MgCu2(2分);
(3)CO2、N2O 、CS2(2分);
(4)sp2、sp3(2分);非极性(2分);
(5)[Cu(NH3)4] SO4(2分);离子键、共价键(极性键)、配位键(3分);
(2)MgCu2(2分);
(3)CO2、N2O 、CS2(2分);
(4)sp2、sp3(2分);非极性(2分);
(5)[Cu(NH3)4] SO4(2分);离子键、共价键(极性键)、配位键(3分);
试题分析:(1)Cu是29号元素Cu+的核外电子数是28,所以Cu+的核外电子排布式为[Ar]3d10或1s22s22p63s23p63d10
(2)根据晶胞结构的“均摊法”,顶点上的占晶胞的1/8,面心上的占晶胞的1/2,体内为1,所以晶胞中Mg原子的个数为8×1/8+6×1/2=4,Cu原子都在体内,个数是8,所以该互化物的化学式为MgCu2;
(3)N3-是3原子16价电子的离子,与其互为等电子体的分子也是3原子16价电子的分子,有CO2、N2O、CS2;
(4)有机物中碳原子的杂化方式依据碳原子周围的单键数,在OHC-CH2CH2OH中,碳原子周围有4个单键,则为sp3杂化,如-CH2CH2OH中的C;有3个单键则为sp2杂化,如OHC-;乙炔正负电荷重心重合,属于非极性分子;
(5)硫酸四氨合铜的化学式为[Cu(NH3)4] SO4,SO42-与配离子之间是离子键,Cu2+与NH3之间是配位键,NH3分子中N、H之间是共价键。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
 图a
图a