题目内容
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在。

请回答下列问题:
(1)X2分子中σ键和π键数目比是 。
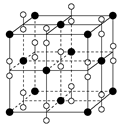
(2)R的晶胞结构如右图所示,该晶胞中所含的原子个数是 。
(3)下列有关X、Y、W的说法正确的是 。
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3-中X的杂化轨道类型为sp3 杂化
④W属于d区的元素
(4) 将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 。
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。

请回答下列问题:
(1)X2分子中σ键和π键数目比是 。
(2)R的晶胞结构如右图所示,该晶胞中所含的原子个数是 。
(3)下列有关X、Y、W的说法正确的是 。
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3-中X的杂化轨道类型为sp3 杂化
④W属于d区的元素
(4) 将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 。
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。
(1)1:2 (2)4 (3)②④ (4)4NH3+2Cu(OH)2=[Cu(NH3)4]2++2OH-
(5)4Na2O2+4Fe2++6H2O=4Fe(OH)3+O2↑+8Na+
(5)4Na2O2+4Fe2++6H2O=4Fe(OH)3+O2↑+8Na+
试题分析:X的基态原子核外有7种不同运动状态的电子,即原子核外电子是7个,是N元素;Y原子最外层有2对成对电子,是第VIA族元素,结合它元素的后面特点,只能是O;Z的原子序数为Y的原子序数的2倍,是S;W3+的基态离子3d轨道为半充满状态,说明W的外围电子为3d64s2,是Fe元素;R的氢氧化物悬浊液可用于检验葡萄糖的存在,R是Cu元素。
(1)N2分子结构式是N≡N,故分子中有1个σ键和2个π键。
(2)Cu晶胞中所含的原子个数是顶角为8个、面心为6个,平均原子数目是8×
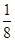 +6×
+6×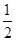 =4。
=4。(3)N是同族元素中非金属最强的,第一电离能最大,①不正确;常温下,液态的H2O分子间存在氢键,②正确;NO3-中N的3对电子都成键,故N原子为sp2杂化,③错;Fe是VIII族元素,是d区。
(4)NH3与Cu(OH)2反应,得到深蓝色[Cu(NH3)4]2+溶液。
(5)将Na2O2是氧化剂,与H2O反应还生成NaOH,首先将Fe2+氧化成Fe3+,并结合OH-生成Fe(OH)3的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,注意反应物计量关系:Na2O2+Fe2++____H2O=Fe(OH)3+2Na++______。将H2O配系数
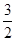 ,O原子还多
,O原子还多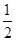 ,故是O2,配系数
,故是O2,配系数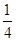 ,然后,反应计量数扩大4倍即可。
,然后,反应计量数扩大4倍即可。
练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目


 OHC-CH2CH2OH。
OHC-CH2CH2OH。