题目内容
下列叙述中正确的是( )
| A.主族元素的原子核外电子最后填入的能级是d能级或f能级 |
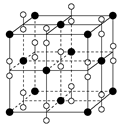
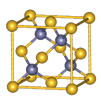
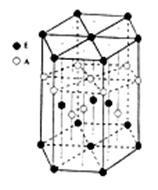
| B.镁型和铜型金属晶体的配位数均为12 |
| C.中心原子上的孤电子对不参与决定分子的空间结构 |
| D.分子中键角越大,价电子对相互排斥力越大,分子越稳定 |
B
试题分析:A.主族元素的原子核外电子最后填入的能级是s能级或p能级.错误。B.镁型金属是六方最密堆积;铜型金属晶体是面心立方堆积,它们的配位数均为12 。正确。C.如在NH3中的中心原子N杂化方式为sp3,在N原子上有一对孤电子对,它对氨分子中的其它共价键产生排斥力,使分子呈三棱锥型。而CH4中的中心原子C杂化方式也为sp3,在C原子上没有孤电子对,分子呈正四面体型。由此可见孤电子对参与决定分子的空间结构。错误。D.分子中键角越大,价电子对相互排斥力越小,分子越稳定。错误。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
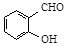 )和对羟基苯甲醛(
)和对羟基苯甲醛(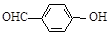 )的沸点
)的沸点

 OHC-CH2CH2OH。
OHC-CH2CH2OH。