题目内容
【物质结构与性质】
碳元素可以组成不同的单质和化合物。
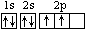
(1)碳原子的电子排布图为_______________
(2)由C和同周期的元素组成的分子如图a,推测分子式是____________,键角为_______。
 图a
图a
(3)CO2分子的结构式为__________,与它等电子体的分子有___________;
(4)第ⅡA金属碳酸盐分解温度如下:
碳酸盐中CO碳原子是________杂化,其空间构型为________________。
解释上列碳酸盐分解温度越来越高的原因是_________________________。
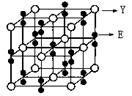
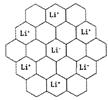
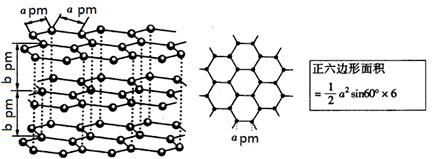
(5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。
则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。


图2 图3
碳元素可以组成不同的单质和化合物。
(1)碳原子的电子排布图为_______________
(2)由C和同周期的元素组成的分子如图a,推测分子式是____________,键角为_______。
 图a
图a(3)CO2分子的结构式为__________,与它等电子体的分子有___________;
(4)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
解释上列碳酸盐分解温度越来越高的原因是_________________________。
(5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。
则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。


图2 图3
(1) (1分);(2)CF4(1分);109°28′(1分)
(1分);(2)CF4(1分);109°28′(1分)
(3)O=C=O(2分),N2O(1分);
(4)sp2(1分);平面三角形;金属阴离子的半径越小,对氧原子的吸引力越大,夺取氧离子的能力越强(2分)。
(5)LiC6(2分),
 (2分)
(2分)  (2分)
(2分)
 (1分);(2)CF4(1分);109°28′(1分)
(1分);(2)CF4(1分);109°28′(1分)(3)O=C=O(2分),N2O(1分);
(4)sp2(1分);平面三角形;金属阴离子的半径越小,对氧原子的吸引力越大,夺取氧离子的能力越强(2分)。
(5)LiC6(2分),
 (2分)
(2分)  (2分)
(2分)试题分析:(1)碳原子有6个电子,电子排布图为
 。
。(2)图中是正四面体的分子式,与C同周期,为-1价,故是CF4,键角是109°28′。
(3)CO2分子的结构式为O=C=O,与它等电子体的分子要求原子个数和价电子数都相等,有N2O。
CO的中心碳原子的价层电子是6(最外层电子+带电荷数),都参加与O原子成键,故是sp2杂化,其空间构型为平面三角形;碳酸盐中金属阴离子的半径越小,对氧原子的吸引力越大,夺取氧离子的能力越强。
图2晶胞中,Li+离子在8个顶角上,平均为1个,C原子有8个在面上,平均为4,心里有2个,共6个碳原子,故化学式为LiC6,从投影来看,Li+最近的2个Li+都是沿着正六边形的一条边过去的,很容易找到其他6个投影的Li+。
注意平行六面体的底是内角为60°的菱形,一个晶胞的体积是
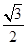 a2b×10-21cm3,故锂电池负极材料的密度为
a2b×10-21cm3,故锂电池负极材料的密度为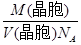 =
= g·cm-3。
g·cm-3。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 OHC-CH2CH2OH。
OHC-CH2CH2OH。