题目内容
4.有短周期元素A、B、C、D、E,已知:①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜;
②B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍;
③E与A同周期,C、D、E三种元素形成的单质或化合物可发生如图所示的反应.
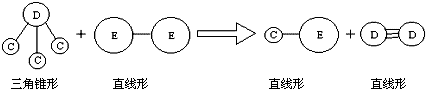
请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O;
(2)D元素的原子结构示意图是:
 ;
;(3)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):HClO4>H2SiO3;
(4)请用化学方程式表示E元素的单质在工业上的一种重要用途:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
分析 短周期元素A、B、C、D、E,①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜,则A为Al元素;②B元素的原子序数比A元素大,B处于第三周期,B原子的次外层的电子数是最外层电子数的2倍,最外层电子数为4,则B为Si元素;③E与A同周期,E的单质为双原子分子,通过单键形成,则E为Cl元素,D与C形成DC3,为三角锥型结构,D的单质通过三键形成的双原子分子,则D为氮元素、C为氢元素,据此解答.
解答 解:短周期元素A、B、C、D、E,①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜,则A为Al元素;②B元素的原子序数比A元素大,B处于第三周期,B原子的次外层的电子数是最外层电子数的2倍,最外层电子数为4,则B为Si元素;③E与A同周期,E的单质为双原子分子,通过单键形成,则E为Cl元素,D与C形成DC3,为三角锥型结构,D的单质通过三键形成的双原子分子,则D为氮元素、C为氢元素,
(1)A元素最高价氧化物为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(2)C为N元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
处于元素周期表中第二周期第ⅤA族,故答案为:二、ⅤA;
(3)B元素与E元素的最高价氧化物的水化物分别为H2SiO3、HClO4,硅酸为弱酸,高氯酸为强酸,酸性:HClO4>H2SiO3,
故答案为:HClO4>H2SiO3;
(4)氯气在工业上可以用于制备漂白粉等,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
点评 本题考查结构性质位置关系用于,难度不大,注意根据分子空间结构与化学键判断元素.

| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式(若无离子方程式,则写化学方程式) |
| Fe(Al) | ||
| CO2(HCl) | ||
| NaHCO3溶液(Na2CO3) | ||
| Al2O3(Al(OH)3) |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
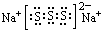 .
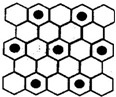
.(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白: