题目内容
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
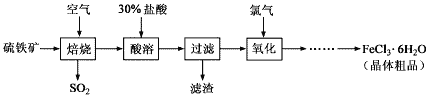
(1)回答下列问题:在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
(2)酸溶及后续过程中均需保持盐酸过量,其目的分别是____、_____。
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则得到的产物为____。
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是(用离子方程式表示)___________,__________,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
【答案】![]() HSO3-的电离程度大于水解程度 提高铁元素的浸出率 抑制Fe3+水解 Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3) Cl2+H2O
HSO3-的电离程度大于水解程度 提高铁元素的浸出率 抑制Fe3+水解 Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3) Cl2+H2O![]() HClO+H++Cl- Cl2+2Fe2+=2Cl-+2Fe3+
HClO+H++Cl- Cl2+2Fe2+=2Cl-+2Fe3+
【解析】
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2![]() 2SO3,该反应的平衡常数表达式为K=
2SO3,该反应的平衡常数表达式为K=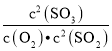 ;
;
过量的SO2与NaOH溶液反应的化学方程式为:SO2+NaOH=NaHSO3,HSO3-的电离程度大于水解程度,溶液呈酸性;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则FeCl3会发生水解反应,即3Fe3++3H2O![]() Fe(OH)3+3H+,且盐酸易挥发,若灼烧则Fe(OH)3分解生成Fe2O3,故最后得到的产物为Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3);
Fe(OH)3+3H+,且盐酸易挥发,若灼烧则Fe(OH)3分解生成Fe2O3,故最后得到的产物为Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3);
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是Cl2+H2O![]() HClO+H++Cl-,Cl2+2Fe2+=2Cl-+2Fe3+,和Fe3++3H2O
HClO+H++Cl-,Cl2+2Fe2+=2Cl-+2Fe3+,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。

 口算题卡北京妇女儿童出版社系列答案
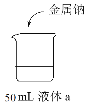
口算题卡北京妇女儿童出版社系列答案【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
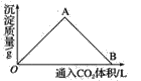
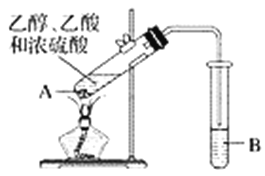
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 除去乙烯、甲烷混合气中的乙烯 | 比较Cl2、I2的氧化性 |
A. A B. B C. C D. D