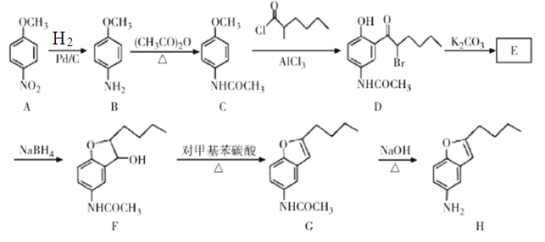
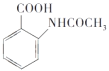
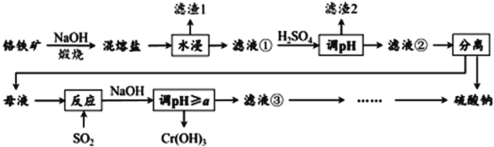
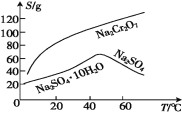
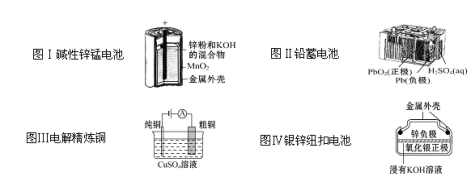
题目内容
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
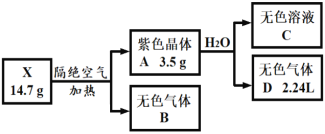
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水,载人宇宙飞船内常用含C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)B的组成元素在元素周期表中的位置是___。
(2)D分子的空间构型为___。
(3)X受热分解转变成A和B的化学反应方程式为___。
【答案】第二周期第VA族 三角锥型 3LiN3![]() Li3N+4N2
Li3N+4N2
【解析】
已知:B是空气的主要成分之一,可能为氮气或氧气,D 遇湿润的红色石蕊试纸变蓝,证明D气体为NH3,物质的量![]() ,推断A紫色晶状物固体为氮化物,结合元素守恒,含氮元素0.1mol,含锂物质的量
,推断A紫色晶状物固体为氮化物,结合元素守恒,含氮元素0.1mol,含锂物质的量![]() ,则化合物A为Li3N,C是微溶于水的强碱,是Li3N和水反应生成的LiOH和氨气,说明X含Li、N元素,B为N2质量=14.7g-3.5g=11.2g,
,则化合物A为Li3N,C是微溶于水的强碱,是Li3N和水反应生成的LiOH和氨气,说明X含Li、N元素,B为N2质量=14.7g-3.5g=11.2g,![]() ,氮元素守恒,X中含氮元素物质的量=0.1mol+0.4mol×2=0.9mol,Li元素物质的量=0.3mol,X化学式中Li:N=0.3:0.9=1:3,化学式为LiN3。
,氮元素守恒,X中含氮元素物质的量=0.1mol+0.4mol×2=0.9mol,Li元素物质的量=0.3mol,X化学式中Li:N=0.3:0.9=1:3,化学式为LiN3。
根据X为LiN3;A为Li3N;B为N2;C为LiOH;D为NH3;
(1)B为N2,在元素周期表中的位置是:第二周期第VA族;
(2)D为NH3,价层电子对个数![]() ,孤电子对个数为1,则分子空间构型为:三角锥型;
,孤电子对个数为1,则分子空间构型为:三角锥型;
(3)X是LiN3,隔绝空气加热分解生成氮气和Li3N,反应的化学方程式:3LiN3![]() Li3N+4N2。
Li3N+4N2。

【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:_____;下列措施能够增大此反应中NO的转化率的是(填字母代号)______。
,请写出此反应的热化学方程式:_____;下列措施能够增大此反应中NO的转化率的是(填字母代号)______。
A.增大容器压强B.升高温度C.使用优质催化剂D.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①05min内,以CO2表示的该反应速率v(CO2)=_______,该条件下的平衡常数K=_____。
②第15min后,温度调整到T2,数据变化如上表所示,则T1____T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应_____移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=____________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)