题目内容
16.如图仪器使用、操作或试剂保存正确的是( )| A. |  移取醋酸 | B. |  盛装NaOH溶液 | C. |  收集氨气 | D. |  除去杂质CO2气体 |
分析 A.醋酸为酸性溶液,需要使用酸式滴定管量取;
B.氢氧化钠为碱性溶液,不能使用玻璃塞的试剂瓶盛放;
C.氨气极易溶于水,不能使用排水法收集;
D.二氧化碳都不与氯化钙溶液反应,无法除去二氧化碳.
解答 解:A.醋酸为弱酸,移取醋酸时需要使用酸式滴定管,图示仪器为酸式滴定管,故A正确;
B.氢氧化钠溶液能够与玻璃塞中的二氧化硅反应,不能使用玻璃塞的试剂瓶盛放,应该使用橡胶塞的试剂瓶,故B错误;
C.氨气极易溶于水,收集氨气不能使用排水法,可以使用排空气法,故C错误;
D.二氧化碳气体不与氯化钙溶液反应,不能使用氯化钙溶液除去一氧化碳的中的二氧化碳,可以使用氢氧化钠溶液,故D错误;
故选A.
点评 本题考查了试剂的存放、气体的收集方法、物质的分离与除杂、仪器的使用方法等知识,题目难度不大,试题知识点较多,充分考查了学生的分析能力及灵活应用基础知识的能力,注意掌握常见试剂的性质及存放方法,明确物质分离与提纯的方法与原则.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法不正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量的液态水和冰,液态水的能量高 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 用福尔马林灭掉活埃博拉病毒是利用了蛋白质变性原理 |
11.以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.4kJ/mol;完成下列填空:
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
第四组实验中以NH3表示反应的速率是33×10-7mol/L•h,与前三组相比,NH3 生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
1.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
8.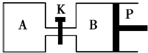 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )| A. | 500℃达平衡时有:c1>c2 | |
| B. | 500℃达平衡时有:a>b>c | |
| C. | 达平衡后打开K,容器B的体积将减小 | |
| D. | 此反应的平衡常数随温度升高而增大 |
5.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
组别 | 甲 | 乙 | 丙 |
| A | NO | NH3 | H2O |
| B | CO2 | Na2CO3 | Ba(OH)2 |
| C | Al | Fe2O3 | HCl |
| D | Cl2 | FeCl2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
14.2014年1月初华北地区连续5~6天出现大雾,致使高速公路封闭、飞机停飞.雾属于下列分散系中的( )
| A. | 胶体 | B. | 悬浊液 | C. | 溶液 | D. | 乳浊液 |
 镍及其化合物应用广泛
镍及其化合物应用广泛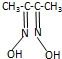 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.