题目内容
14.作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用,与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.(1)反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示,则pH=8时,ClO2被还原为ClO2-.
(2)亚氯酸根离子(ClO2-)对人体不利,欲在弱碱性条件下将水中的ClO2-转化为Cl-除去,若该反应体系中的物质有NaClO2、Fe(OH)3、NaHCO3、FeC
 l2、NaCl、H2O、CO2,写出并配平有关化学方程式,并标出电子转移的方向和数目
l2、NaCl、H2O、CO2,写出并配平有关化学方程式,并标出电子转移的方向和数目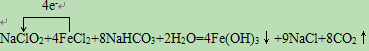 .
.
分析 (1)根据图中的信息:当pH=8时,ClO2被还原为ClO2-的转化率是100%.
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据化合价的升降来判断回答.
解答 解:(1)根据图中的信息:当pH=8时,ClO2被还原为ClO2-的转化率是100%,故答案为:ClO2-.
(2)在弱碱性条件下水中的ClO2-转化为Cl-,体现氧化性,该反应体系中的物质NaClO2具有氧化性,FeCl2具有还原性,反应为:NaClO2+NaHCO3+4eCl2+H2O→4e(OH)3+NaCl+CO2↑,该氧化还原反应中,Cl失电子,Fe得到电子,化合价升高值=化合价降低值=转移电子数=4,NaClO2+4FeCl2+8NaHCO3+2H2O=4Fe(OH)3↓+9NaCl+8CO2↑,电子转移表示为: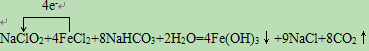 ,故答案为:
,故答案为: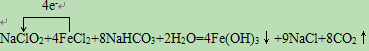 .
.
点评 本题考查学生氧化还原反应的电子转移的有关知识,注重基本概念的考查,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某芳香族化合物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 一个醛基 | B. | 一个羧基 | C. | 两个羟基 | D. | 两个醛基 |
2.下列关于有机物的性质或应用说法不正确的是( )
| A. | 淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| B. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 | |
| C. | 煤通过干馏可得到焦炭、煤焦油、焦炉气、粗氨水等 | |
| D. | 油脂皂化反应的产物是高级脂肪酸盐和甘油 |
6. 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=0.25(保留两位小数).
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol.
(2)还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)?N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
②前10min内用v(NO)表示的化学反应速率为0.0042mol/(L.min);30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H<0(填“>”“=”或“<”).
(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.a为负极,电极反应式为CO-2e-+O2-═CO2.电池工作过程中,O2-由b极(填“a”或“b”,下同)移向a极.
②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车不符合(填“符合”或“不符合”)欧IV排放标准.
3.下列说法不正确的是( )
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
4. 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )| A. | BaTiO3 | B. | BaTi8O12 | C. | BaTiO4 | D. | BaTi8O4 |
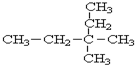 3,3-二甲基戊烷.
3,3-二甲基戊烷. .再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为
.再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为 .从分液漏斗上口倒出的液体是苯.
.从分液漏斗上口倒出的液体是苯.