题目内容
2.下表是大气固氮和工业固氮在不同温度下的K值,下列叙述吧正确的是的是( )| 反应 | 大气固氮 | 工业固氮 | |||
| N2(g)+02(g)? 2NO(g) | N2(g)+3H2 (g)?2NH3(g) | ||||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84X10-31 | 0.1 | 5x103 | 0.507 | 0.152 |
| A. | 分析上表数据可知,大气固氮反应属于吸热反应 | |
| B. | 大气固氮正向反应K值太小,不适合大规模生产 | |
| C. | 从催化剂活性、反应速率等综合因索考虑,工业固氮应该选择适宜的温度 | |
| D. | 从平衡理论考虑,加压有利于氨的合成,所以在生产时压强越大越好 |
分析 A、从表一可以看出,随着温度的升高,K值增大,表明正向是吸热的方向;
B、从表一数据还可以看出,即使是升高到2000℃,氮气与氧气生成一氧化氮的平衡常数也只达到0.1,表明人类大规模模拟大气固氮是没有意义的,不适合大规模生产;
C、合成氨反应中,在500℃左右催化剂活性最高;
D、工业固氮加压有利于氨的合成,但压强过大对设备的要求越高.
解答 解:A、从表一可以看出,随着温度的升高,K值增大,表明正向是吸热的方向,所以大气固氮反应属于吸热反应,故A正确;
B、从表一数据还可以看出,即使是升高到2000℃,氮气与氧气生成一氧化氮的平衡常数也只达到0.1,但是对于人工合成氨来说,就是在25℃,其平衡常数也达到了5×108,表明人类大规模模拟大气固氮是没有意义的,不适合大规模生产,故B正确;
C、工业固氮,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适,故C正确;
D、工业固氮加压有利于氨的合成,但压强过大对设备的要求越高,所以在生产时并不是压强越大越好,故D错误;
故选D.
点评 本题考查影响化学平衡的因素等知识,题目难度中等,注意掌握化学平衡及影响因素.

练习册系列答案
相关题目
10.如图是部分短周期元素原子半径与原子序数的关系图,则下列说法正确的是( )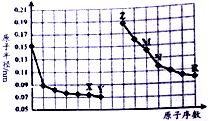

| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
17.根据元素周期律,对下列事实进行归纳推测,推理不合理的是( )
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Ba与水反应会更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | ⅣA族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
7.能实现 转变为的
转变为的 操作是( )
操作是( )
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
14.元素钴的+3价配合物化学式为CoClm•nNH3,中心原子的配位数为6,NH3只做配体.若lmol该配合物的水溶液与足量AgN03反应,生成2mol AgCl,则m和n的值是( )
| A. | m=5,n=l | B. | m=3,n=5 | C. | m=3,n=4 | D. | m=3,n=6 |
8.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不正确的是( )
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 增加CO,CO的平衡转化率增大 | |
| D. | 若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ |

 ,该反应的反应类型是加成反应.
,该反应的反应类型是加成反应.