题目内容
2.实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
分析 KClO3+6HCl=KC1+3Cl2↑+3H2O中,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:反应中只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
KClO3中氯元素化合价,为氧化剂,对应Cl2为还原产物,HCl中Cl元素的化合价升高为还原剂,对应的Cl2为氧化产物,氧化产物与还原产物的物质的量之比是5:1;
故答案为: ;Cl2;Cl2;5:1.
;Cl2;Cl2;5:1.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
12.下列实验操作中数据合理的是( )
| A. | 用100mL容量瓶配制50mL 0.1mol/L的盐酸 | |
| B. | 用10mL 量筒量取5.2mL盐酸 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 用pH试纸测得某溶液的pH值为12.5 |
10.下列关于电化学的理解正确的是( )
| A. | 原电池一定是负极材料失电子,发生氧化反应 | |
| B. | 电解池的电极材料一定不参与电极反应 | |
| C. | 原电池的负极和电解池的阳极一定发生氧化反应 | |
| D. | 原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
7.下列属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | K2SO4 | D. | NaOH |
14.如图所示进行实验,下列说法不正确的是( )
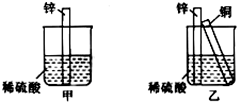

| A. | 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 | |
| B. | 甲、乙装置中的能量变化均为化学能转化为电能 | |
| C. | 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转 | |
| D. | 装置乙中负极的电极反应式:Zn-2e-═Zn2+ |
12.下列各组物质中,互为同系物的是( )
| A. | O2、O3 | B. |  | ||
| C. | 2-甲基丙烷、乙烷 | D. | 油酸、硬脂酸 |