题目内容
10.下列关于电化学的理解正确的是( )| A. | 原电池一定是负极材料失电子,发生氧化反应 | |
| B. | 电解池的电极材料一定不参与电极反应 | |
| C. | 原电池的负极和电解池的阳极一定发生氧化反应 | |
| D. | 原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
分析 A.原电池负极上失去电子发生氧化反应,但不一定为负极材料失电子;
B.电解池的阳极为活性电极时,本身失电子参与电极反应;
C.原电池的负极和电解池的阳极都是失电子发生氧化反应;
D.原电池中的阳离子移向正极,电解池中的阳离子则移向阴极.
解答 解:A.原电池负极上失去电子发生氧化反应,但不一定为负极材料失电子,例如燃料电池,故A错误;
B.电解池的阳极为活性电极时,本身失电子参与电极反应,故B错误;
C.原电池的负极和电解池的阳极都是失电子发生氧化反应,故C正确;
D.原电池中的阳离子移向正极,电解池中的阳离子则移向阴极,故D错误;
故选C.
点评 本题考查原电池、电解池工作原理,比较基础,注意对基础知识的理解掌握,侧重于电极反应和离子流向的考查.

练习册系列答案
相关题目
5.在通风橱中进行下列实验:
下列说法中不正确的是( )
| 步骤 | 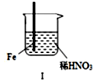 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 | |
| B. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| C. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
15.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol氢氧根离子与1mol羟基所含电子数均为l0NA | |
| B. | 2.8gN2和CO的混合物中,所含分子总数为0.2NA | |
| C. | 标准状况下,11.2L甲醛气体所含σ键数目为1.5NA | |
| D. | 2.24LC02与足量的Na202反应,转移的电子总数必为0.1NA |
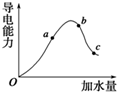 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.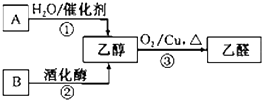 气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图:
气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图: 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.