题目内容
11.(1)写出实验室制备Fe(OH)3胶体的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.(2)Fe(OH)3胶粒直径在1nm至100nm之间,能证明Fe(OH)3胶体粒子小于浊液中分散质粒子的事实是Fe(OH)3胶体能透过滤纸.
(3)下列有关Fe(OH)3胶体的说法正确的是D.
A.是棕黄色的液体
B.可用FeCl3溶液与NaOH溶液反应制取
C.通电后Fe(OH)3胶粒定向移动而导电,所以Fe(OH)3胶体是电解质
D.向该液体中加入AgNO3溶液,有沉淀产生.
分析 (1)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
(2)胶体分散质微粒直径介于1nm~100nm之间;浊液不能透过滤纸;
(3)A.Fe(OH)3胶体呈红褐色; B.FeCl3溶液与NaOH溶液反应生成氢氧化铁沉淀;
C.电解质是指在水溶液中或在熔融状态下能够导电(电解离成阳离子与阴离子)的化合物;
D.Fe(OH)3胶体有氯离子.
解答 解:(1)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)Fe(OH)3胶体分散质微粒直径介于1nm~100nm之间;浊液不能透过滤纸,Fe(OH)3胶体能透过滤纸,故答案为:1;100;Fe(OH)3胶体能透过滤纸;
(3)A.Fe(OH)3胶体呈红褐色,氯化铁溶液为棕黄色,故A错误; B.FeCl3溶液与NaOH溶液反应生成氢氧化铁沉淀,不是胶体,故B错误;
C.Fe(OH)3胶体是分散系,不是化合物,故C错误;
D.Fe(OH)3胶体有氯离子,能与AgNO3溶液反应生成氯化银沉淀,故D正确.
故答案为:D.
点评 本题考查学生Fe(OH)3胶体的性质、制备等知识,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
相关题目
2.实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
6.下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④分散系一定是混合物
⑤浊液均可用过滤的方法分离.
①酸性氧化物肯定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④分散系一定是混合物
⑤浊液均可用过滤的方法分离.
| A. | ①③ | B. | ④⑤ | C. | ②④ | D. | ③④ |
3.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是( )
| A. | 金属焊接时可用NH4Cl溶液作除锈剂 | |
| B. | 配制FeSO4溶液时,加入一定量Fe粉 | |
| C. | 长期施用铵态氮肥会使土壤酸化 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有气泡产生 |
1.短周期元素X,Y,Z,W,R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y原子的最外层只有1个电子,Z所处的周期序数与族序数相等,W元素最高正价与最低负价绝对值相等,R与X同族,则( )
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
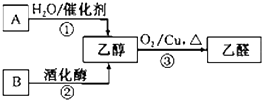 气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图:
气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图: 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.