题目内容
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
【答案】取最后一次洗涤液,加入足量硝酸后,滴加AgNO3溶液,没有沉淀生成,证明洗涤干净 2.4% B ①
【解析】
(1)判断沉淀是否洗涤干净就是看沉淀的表面是否含有Cl-;灼烧固体物质一般放在坩埚中进行;根据硫酸根离子守恒进行计算;
(2)为有效除去老卤中的MgCl2、CaCl2 、MgSO4等,可以加入过量KOH (去除镁离子);加入过量BaCl2 (去除硫酸根离子);加入过量K2CO3 (去除钙离子和多余的钡离子)。
(1)判断沉淀是否洗涤干净就是看沉淀的表面是否含有Cl-,其方法为:取最后一次洗涤流出液,加入足量硝酸后,滴加AgNO3溶液,没有沉淀生成,证明洗涤干净;灼烧固体物质一般放在坩埚中进行,所以仪器A的名称为坩埚;根据硫酸根离子守恒,n( MgSO4 ) =n ( BaSO4 ) =![]() =
=![]() =0.002mol,m ( MgSO4 ) =nM=0.002mol×120g/mol=0.24g,则样品中MgSO4的质量分数为
=0.002mol,m ( MgSO4 ) =nM=0.002mol×120g/mol=0.24g,则样品中MgSO4的质量分数为![]() ×100%=2.4%;
×100%=2.4%;
(2)为有效除去老卤中的MgCl2、CaCl2 、MgSO4等,可以加入过量KOH (去除镁离子): Mg2+ +2OH-=Mg(OH)2↓;加入过量BaCl2 (去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量K2CO3 (去除钙离子和多余的钡离子) :Ca2++CO32-=CaCO3↓,碳酸钾必须加在氯化钡之后,氢氧化钾和氯化钡可以颠倒加入的顺序,或直接加入过量的Ba(OH)2 (去除镁离子和硫酸根离子), 再加入加入过量K2CO3 (去除钙离子和多余的钡离子) , 故加入的试剂及顺序合理的是⑦⑤②或⑥②,所以选B;过滤除去沉淀后还需要加入的试剂为盐酸,加适量盐酸,可以少引入杂质,并且盐酸与过量的KOH溶液和过量的K2CO3溶液发生反应,离子方程式为H+ +OH-=H2O、CO32- +2H+ =H2O+CO2↑,从而除掉过量的OH-、CO32- ,故答案为B;①。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=____kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
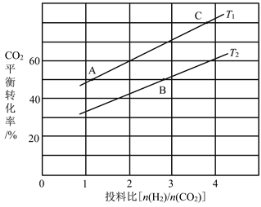
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%
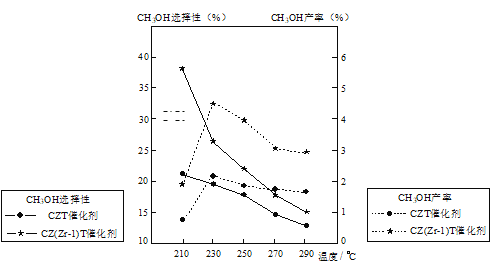
①温度高于230℃,CH3OH产率随温度升高而下降的原因是_____。
②在上述条件下合成甲醇的工业条件是____。
p>A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 | ||
二苯基羟乙酮 | 212 | 133 | 344 | 1.310 | 不溶于冷水,溶于乙醇 | |
二苯基乙二酮 | 210 | 97 | 348 | 1.084 | 不溶于水,能溶于乙醇 |
 +2FeCl3
+2FeCl3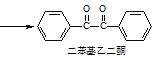 +2FeCl2+2HCl
+2FeCl2+2HCl
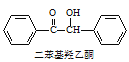
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
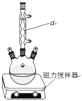
(1)装置图中仪器a的名称是____,其作用是____。
(2)加入碎瓷片的作用是____。若加热后发现未加碎瓷片,应采取的正确方法是___。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。如图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:

该实验条件下加热____后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是____。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是_____。
(7)本实验的产率是____%。(保留3位有效数字)