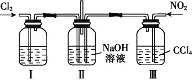
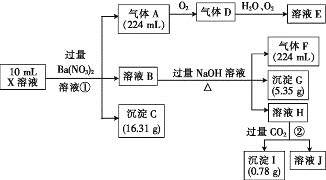
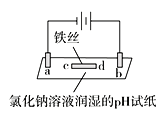
题目内容
【题目】(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH。其中能导电的是___,(填序号,下同),属于电解质的是___,属于非电解质的是___。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q___2p(填“大于”、“小于”、或“等于”)。
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为____%(小数点后保留一位数字);若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为____%。
【答案】③⑤⑥⑦ ②④⑦ ① 大于 33.3 40
【解析】
(1)电解质和非电解质均为化合物,酸、碱、盐、金属氧化物等均属于电解质,绝大部分有机物、非金属氧化物、非金属氢化物等为非电解质;据此可以推出属于电解质的是②NaHCO3晶体、④纯醋酸、⑦熔融KOH;属于非电解质的是①干冰;金属都能导电,存在自由移动的离子的物质都能导电,其中能导电的是③氨水、⑤FeCl3溶液、⑥铜⑦熔融KOH;正确选项:③⑤⑥⑦;②④⑦;①;
(2)令质量分数为p%的硫酸的密度为dg/mL,3p%的硫酸的密度为Dg/mL,溶液体积为VmL,则混合后溶液的质量为:dg/mL×VmL+Dg/mL×VmL=V(d+D)g,混合后溶质硫酸的总质量为dg/mL×VmL×p%+Dg/mL×VmL×3p%=V(d×p%+D×3p%)g,混合后硫酸的质量分数q%=![]() =p%+
=p%+![]() =p%+2p%×
=p%+2p%×![]() ,硫酸溶液的浓度越大,其密度越大,则d<D,故1+
,硫酸溶液的浓度越大,其密度越大,则d<D,故1+![]() <2,所以2p%×
<2,所以2p%×![]() >p%,q%>2p%,即q>2p,正确答案是大于;
>p%,q%>2p%,即q>2p,正确答案是大于;
(3)三种气体混合气体的平均相对分子质量为20×2=40,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设混合气体的总物质的量为1mol,其中SO2的物质的量为xmol,则CO和N2的物质的量之和为(1x)mol,因此有:64x+28(1x)=40×1,解得x=![]() 。SO2的体积分数为
。SO2的体积分数为![]() ×100%=33.3%;若CO和N2的物质的量之比为1∶1,设混合气体为1mol,则混合气体中SO2的物质的量为:
×100%=33.3%;若CO和N2的物质的量之比为1∶1,设混合气体为1mol,则混合气体中SO2的物质的量为:![]() mol,CO和N2的物质的量都是(1-
mol,CO和N2的物质的量都是(1-![]() )÷2=
)÷2=![]() mol,混合气体中氧元素的物质的量为
mol,混合气体中氧元素的物质的量为![]() ×2+
×2+![]() =1mol,氧元素的质量分数为
=1mol,氧元素的质量分数为![]() ×100%=40%。
×100%=40%。

 阅读快车系列答案
阅读快车系列答案【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,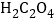 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快