题目内容
【题目】A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+离子与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于元素周期表的位置_______;
(2)G的离子结构示意图为________;
(3)用电子式表示D2的形成过程:_________;
(4)由A、E、F三种元素形成的化合物的化学式为_____,含有的化学键有____(填化学键类型)。
【答案】第三周期第ⅠA族 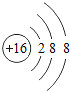
![]() NaOH 离子键和共价键(极性共价键)
NaOH 离子键和共价键(极性共价键)
【解析】
由A与其他非金属元素化合时易形成共价键,且原子序数最小,可推测A为H元素;由F与其他非金属元素化合时易形成离子键且F与A同主族,再结合原子序数的大小关系,可推测F为Na元素;由F+离子与E2-核外电子排布相同,易知与Na+核外电子排布相同的是O2-,说明E为O元素;E和G同主族,说明G是S元素;D介于B和E之间,若BE为CO,那么根据BE和D2的电子总数相等去推测,可知D2为N2,符合题意,则B是C元素,D是N元素。
(1)F为钠元素,其位于周期表中第三周期第ⅠA族。
(2)G为硫元素,S2-质子数是16,核外电子数是18,因而该离子结构示意图是 。
。
(3)用电子式表示D2即N2的形成过程,需要注意写出N原子电子式和N2电子式,因而过程可表示为![]() 。
。
(4)A、E、F三种元素分别为H、O、Na,易知形成的化合物是NaOH,氢氧化钠是离子化合物,含有离子键,同时氢、氧原子之间是极性共价键,因而答案为:离子键和共价键(极性键)。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目