题目内容
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
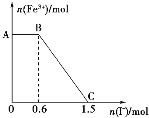
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)
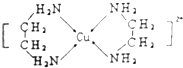
①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
【答案】H2S、NH2- A [Cu(H2O)4]2+ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O [Cu(NH3)4]SO4·H2O O>N>H 乙二胺分子间能形成氢键
【解析】
I.(1)H2O分子中的原子数为3、价电子数为8,H2S、NH2-的原子数目均为3,价电子数目均为8,则与水互为等电子体,故答案为:H2S、NH2-;
(2)A、水中氧原子为sp3杂化,H3O+中氧原子也为sp3杂化,氧原子的杂化类型没有改变,故A错误;
B、水分子的空间构型为V型,H3O+的空间构型为三角锥型,则微粒的形状发生了改变,故B正确;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A;
II.(3)将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为Cu2+与H2O生成了一种呈蓝色的配离子[Cu(H2O)4]2+;氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;再向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:[Cu(NH3)4]SO4·H2O,故答案为:[Cu(H2O)4]2+;Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;[Cu(NH3)4]SO4·H2O;
(4)①非金属性越强电负性越大,H、N、O三种元素的非金属性由大到小的顺序是:O>N>H,则电负性由大到小的顺序是:O>N>H,故答案为:O>N>H;
②乙二胺分子间存在氢键,Cl-CH2CH2-Cl分子间不能形成氢键,含有分子间氢键的物质沸点较高,所以乙二胺沸点高于Cl-CH2CH2-Cl,故答案为:乙二胺分子间能形成氢键。

 综合自测系列答案
综合自测系列答案