题目内容
(1)25℃时,1g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.64kJ热量,写出该反应的热化学方程式: .
(2)利用原电池原理保护金属的一种方法称为 ,利用电解池原理保护金属的方法称为 .
(3)化学平衡移动原理被人们称为勒夏特列原理,其内容是 .
(4)如果将甲醇制成燃料电池,可以提高其能量利用率.以KOH溶液为电解质溶液,在两极分别通入甲醇和氧气,则通入甲醇的一极为 极,其电极反应式为: .
(2)利用原电池原理保护金属的一种方法称为
(3)化学平衡移动原理被人们称为勒夏特列原理,其内容是
(4)如果将甲醇制成燃料电池,可以提高其能量利用率.以KOH溶液为电解质溶液,在两极分别通入甲醇和氧气,则通入甲醇的一极为
考点:热化学方程式,原电池和电解池的工作原理,化学电源新型电池,化学平衡移动原理
专题:基本概念与基本理论
分析:(1)依据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(2)电化学保护法:利用原电池原理的牺牲阳极的阴极保护法;利用电解池原理的外加电流的阴极保护法;
(3)勒夏特列原理内容为:如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动;
(4)燃料原电池中,燃料失电子发生氧化反应为负极,通入氧气得到电子发生还原反应为正极;
(2)电化学保护法:利用原电池原理的牺牲阳极的阴极保护法;利用电解池原理的外加电流的阴极保护法;
(3)勒夏特列原理内容为:如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动;
(4)燃料原电池中,燃料失电子发生氧化反应为负极,通入氧气得到电子发生还原反应为正极;
解答:
解:(1)1g 甲烷生成液态水和二氧化碳气体,放出55.64kJ的热量,16g甲烷燃烧放热890.2KJ,热化学方程式为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.2kJ?mol-1;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.2kJ?mol-1;
(2)利用原电池原理保护金属的一种方法称为牺牲阳极的阴极保护法;利用电解池原理保护金属的方法称为外加电流的阴极保护法;
故答案为:牺牲阳极的阴极保护法;外加电流的阴极保护法;
(3)勒夏特列原理内容为:如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动.
故答案为:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动.
(4)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O;
故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.2kJ?mol-1;
(2)利用原电池原理保护金属的一种方法称为牺牲阳极的阴极保护法;利用电解池原理保护金属的方法称为外加电流的阴极保护法;
故答案为:牺牲阳极的阴极保护法;外加电流的阴极保护法;
(3)勒夏特列原理内容为:如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动.
故答案为:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动.
(4)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O;
故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O;
点评:本题主要考查了热化学方程式的书写、金属的电化学防护、勒夏特列原理、电极反应,电极反应的书写难度较大.

练习册系列答案
相关题目
下列关于有机物的叙述,错误的是( )
| A、乙烯能使溴水和酸性KMnO4溶液褪色 |
| B、体积分数为75%的酒精溶液会使细菌蛋白质变性 |
| C、1mol甲烷和1mol氯气在光照条件下充分反应,生成1mol CH3Cl |
| D、CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体 |
Li-FePO4电池放电时的电池反应为:FePO4+Li═LiFePO4,电解质为含Li+的导电固体.下列有关Li-FePO4电池说法正确的是( )
| A、可加入硫酸以提高电解质的导电性 |
| B、充电时LiFePO4只发生还原反应 |
| C、充电过程中,电池正极材料的质量增大 |
| D、放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
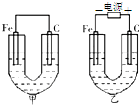 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答:
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答: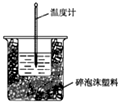 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: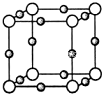 (1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为
(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为