题目内容
水是组成生命体的重要化学物质,有关水的反应实例有很多.
(1)在下列反应中,水仅被还原的是 .
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O
Fe3O4+4H2
(2)过氧化钠与水发生剧烈反应,反应时放出热量.写出此反应的化学方程式并标出电子转移的方向和数目(用单线桥表示): .
(3)漂白粉常用于饮用水的杀菌消毒.漂白粉溶于水后,与空气中的CO2作用,能产生有漂白、杀菌作用的次氯酸.这一过程的化学反应方程式为 .
(1)在下列反应中,水仅被还原的是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O
| ||
(2)过氧化钠与水发生剧烈反应,反应时放出热量.写出此反应的化学方程式并标出电子转移的方向和数目(用单线桥表示):
(3)漂白粉常用于饮用水的杀菌消毒.漂白粉溶于水后,与空气中的CO2作用,能产生有漂白、杀菌作用的次氯酸.这一过程的化学反应方程式为
考点:氧化还原反应,氯、溴、碘及其化合物的综合应用,钠的重要化合物
专题:氧化还原反应专题
分析:(1)水仅被还原,说明水得电子作氧化剂;
(2)过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠中O元素化合价由-1价变为-2价和0价;
(3)漂白粉的有效成分是次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸.
(2)过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠中O元素化合价由-1价变为-2价和0价;
(3)漂白粉的有效成分是次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸.
解答:
解:(1)水仅被还原,说明水得电子作氧化剂,
A.Cl2+H2O=HCl+HClO中水中各元素化合价不变,Cl元素化合价由0价变为-1价、+1价,所以水既不是氧化剂也不是还原剂,故A错误;
B.2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价、-2价,水中各有化合价不变,则水既不是氧化剂也不是还原剂,故B错误;
C.CaH2+2H2O=Ca(OH)2+2H2↑中水中H元素部分化合价由+1价变为0价,所以水是氧化剂,在反应中被还原,故C正确;
D.3Fe+4H2O
Fe3O4+4H2中H元素化合价由+1价变为0价,所以水是氧化剂,在反应中被还原,故D正确;
故选CD;
(2)过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠中O元素化合价由-1价变为-2价和0价,其电子转移方向和数目为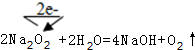 ,
,
故答案为: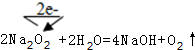 ;
;
(3)漂白粉的有效成分是次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
A.Cl2+H2O=HCl+HClO中水中各元素化合价不变,Cl元素化合价由0价变为-1价、+1价,所以水既不是氧化剂也不是还原剂,故A错误;
B.2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价、-2价,水中各有化合价不变,则水既不是氧化剂也不是还原剂,故B错误;
C.CaH2+2H2O=Ca(OH)2+2H2↑中水中H元素部分化合价由+1价变为0价,所以水是氧化剂,在反应中被还原,故C正确;
D.3Fe+4H2O
| ||
故选CD;
(2)过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠中O元素化合价由-1价变为-2价和0价,其电子转移方向和数目为
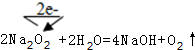 ,
,故答案为:
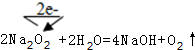 ;
;(3)漂白粉的有效成分是次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
点评:本题考查了氧化还原反应,熟悉元素化合价是解本题关键,注意过氧化钠中O元素化合价,题目难度不大.

练习册系列答案
相关题目
查看下列酒类饮品的商品标签,其中酒精含量最高的是( )
| A、啤酒 | B、白酒 | C、葡萄酒 | D、黄酒 |
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A、同一元素的单质,不可能既能与酸反应,又能与碱反应 |
| B、IA族元素的金属性一定比IIA族元素的金属性强 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减小 |
 (1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为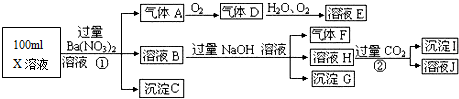
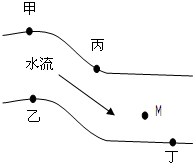 在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:(1)甲处河水呈乳白色;(2)乙处河水呈浅蓝色浑浊;(3)丙处河水由浑变清;(4)丁处产生气泡,河水仍清.请推断:
在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:(1)甲处河水呈乳白色;(2)乙处河水呈浅蓝色浑浊;(3)丙处河水由浑变清;(4)丁处产生气泡,河水仍清.请推断: