题目内容
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)制氢的热化学方程式为_____________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率![]() =____%,反应平衡常数K=_____。
=____%,反应平衡常数K=_____。
(3)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
【答案】H2O(l)=H2(g)+ ![]() O2(g) ΔH=+286 kJ/mol 2.5 2.85×10–3 6.2×10-8 0.62
O2(g) ΔH=+286 kJ/mol 2.5 2.85×10–3 6.2×10-8 0.62
【解析】
(1)系统(Ⅰ)涉及水的分解,利用盖斯定律分别将系统(Ⅰ)的热化学方程式相加,可得到水分解的热化学方程式,则系统(I)的热化学方程式H2O(l)=H2(g)+![]() O2(g)△H=+286kJ/mol;
O2(g)△H=+286kJ/mol;
(2)对于反应 H2S(g)+CO2(g) ![]() COS(g)+H2O(g)
COS(g)+H2O(g)
起始(mol) 0.40 0.10 0 0
转化(mol) x x x x
平衡(mol) 0.40-x 0.10-x x x
反应平衡后水的物质的量分数为0.02,则![]() =0.02,x=0.01,H2S的平衡转化率a1=
=0.02,x=0.01,H2S的平衡转化率a1=![]() ×100%=2.5%;体积为2.5L,则平衡时各物质的浓度为c(H2S)=
×100%=2.5%;体积为2.5L,则平衡时各物质的浓度为c(H2S)=![]() mol/L=0.156mol/L,c(CO2)=
mol/L=0.156mol/L,c(CO2)=![]() mol/L=0.036mol/L,c(COS)=c(H2O)=
mol/L=0.036mol/L,c(COS)=c(H2O)=![]() mol/L=0.004mol/L,则K=
mol/L=0.004mol/L,则K=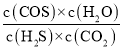 =
=![]() =2.85×10–3;
=2.85×10–3;
(3)NH3H2O的Kb=1.8×10-5,若氨水的浓度为2.0molL-1,由Kb=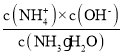 可知c(OH-)=
可知c(OH-)=![]() mol/L=6.0×10-3mol/L;当c(OH-)降至1.0×10-7molL-1时,
mol/L=6.0×10-3mol/L;当c(OH-)降至1.0×10-7molL-1时,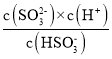 可知c(SO32-)/c(HSO3-)=0.62。
可知c(SO32-)/c(HSO3-)=0.62。

【题目】环境问题已经是我国面临的重大问题.
Ⅰ![]() 减少二氧化碳的排放是一项重要课题.研究表明,
减少二氧化碳的排放是一项重要课题.研究表明,![]() 经催化加氢可合成低碳醇:
经催化加氢可合成低碳醇:![]() 几种化学键的键能如表所示
几种化学键的键能如表所示
化学键 |
|
|
|
|
|
|
键能 | 803 | 436 | 332 | 409 | 463 | 326 |
通过计算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密闭容器中投入
恒容密闭容器中投入![]() 和
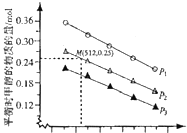
和![]() 发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为![]() ,温度为512K时,向该容器中投入
,温度为512K时,向该容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 时,平衡向 ______ 方向移动.
时,平衡向 ______ 方向移动.
![]() 以
以![]() 、空气
、空气![]() 含量
含量![]() 、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解
、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解![]()
![]() 溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
Ⅱ![]() 也是一种大气污染物,可以用海水处理含
也是一种大气污染物,可以用海水处理含![]() 的废气,海水中主要离子的含量如下:
的废气,海水中主要离子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水经初步处理后,还含有
海水经初步处理后,还含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰浆使海水中的
,向其中加入石灰浆使海水中的![]() 转换为
转换为![]() ,当
,当![]() 刚好沉淀完全时,
刚好沉淀完全时,![]()
![]() 为 ______
为 ______ ![]()
已知![]()
![]()
![]() 处理过的废气中
处理过的废气中![]() 的含量可以通过碘量法来测定.用到的试剂有:
的含量可以通过碘量法来测定.用到的试剂有:![]() 的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟
的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟![]() 标况下
标况下![]() 的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中
的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是______(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
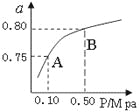
(3)判断反应③△H______0; △S______0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)______v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是__________________。
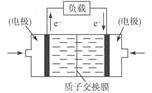
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:______________________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为_________________________________。
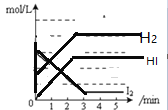
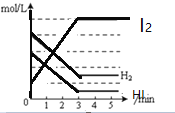
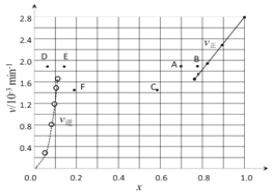
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。