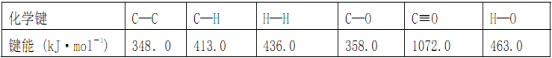
��Ŀ����
����Ŀ��500 mL NaNO3��Cu(NO3)2�Ļ����Һ��c(NO![]() )��6 mol/L����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ�������22.4 L(��״����)���ٶ�������Һ�����Ϊ500 mL������˵����ȷ����( )
)��6 mol/L����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ�������22.4 L(��״����)���ٶ�������Һ�����Ϊ500 mL������˵����ȷ����( )
A��ԭ�����Һ��c(Na��)��6 mol
B������õ���Cu�����ʵ���Ϊ2 mol
C�������������й�ת��8 mol����
D��������Һ��c(H��)��4 mol/L
���𰸡�D
��������
���������ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���22.4L����(��״��)��n(O2)=![]() =1mol������������Ӧ4OH--4e-�TO2��+2H2O��ת�Ƶĵ���Ϊ4mol����������Cu2++2e-�TCu��2H++2e-�TH2��������1mol����ת��2mol���ӣ���˻�������1molͭ��A��c(Cu2+)=
=1mol������������Ӧ4OH--4e-�TO2��+2H2O��ת�Ƶĵ���Ϊ4mol����������Cu2++2e-�TCu��2H++2e-�TH2��������1mol����ת��2mol���ӣ���˻�������1molͭ��A��c(Cu2+)=![]() =2mol/L���ɵ���غ��֪��ԭ�����Һ��c(Na+)Ϊ6mol/L-2mol/L��2=2mol/L����A����B�����õ���Cu�����ʵ���Ϊ1mol����B����C��������������֪����������ת�Ƶ�������Ϊ4NA����C����D��������Һ��c(H+)Ϊ
=2mol/L���ɵ���غ��֪��ԭ�����Һ��c(Na+)Ϊ6mol/L-2mol/L��2=2mol/L����A����B�����õ���Cu�����ʵ���Ϊ1mol����B����C��������������֪����������ת�Ƶ�������Ϊ4NA����C����D��������Һ��c(H+)Ϊ![]() =4mol/L����D��ȷ����ѡD��
=4mol/L����D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ