题目内容
【题目】A、B、C、D、E、F是原子序数依次增大的六种常见元素,其中A原子最外层电子数比次外层电子数多2个电子;B的阴离子与C的阳离子电子数之和为20,质子数相差3;E2、EB2均是生活生产中常见的杀菌消毒剂;气体DB2中D的质量分数为50%;A与F形成一种化合物M可与水反应生成一种可燃性的直线型分子N。根据以上信息回答下列问题:
(1)用一个反应方程式说明D与E的非金属性强弱关系___________________________。
(2)M的电子式___________________________________________________。
(3)汽车安仝气囊中的叠氮化钠NaN3可用次氯酸钠溶液销毁,写出反应的化学方程式:______________________,每生成1molN2,转移的电子数为_____________________________。
(4)自来水厂常用EB2对饮用水进行杀菌消毒,处理后的水中要求EB2的残留的浓度为![]() ,一般可用碘量法对其进行检测,现操作步骤如下:
,一般可用碘量法对其进行检测,现操作步骤如下:
Ⅰ、取1L水样加硫酸酸化,向其中加入足量的KI溶液,充分反应后,用NaOH溶液调节溶液至中性,加入淀粉溶液。
Ⅱ、用![]() 溶液滴定Ⅰ所得溶液,测得所用体积为
溶液滴定Ⅰ所得溶液,测得所用体积为![]()
①步骤Ⅰ中EB2与碘化钾溶液反应的离子方程式为___________________________________。
②滴定终点的现象_________________________________________________________。
③步骤Ⅰ中调节溶液至中性的原因是________________________________________。
④该水样中EB2的浓度为______________________________mg/L。(保留到小数点后两位)
【答案】![]() 或
或![]()
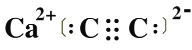
![]()
![]()
![]() 溶液由蓝色变为无色,半分钟内不恢复为蓝色
溶液由蓝色变为无色,半分钟内不恢复为蓝色 ![]() 在酸性条件下反应/歧化反应;I2在碱性条件下反应/歧化反应 0.71
在酸性条件下反应/歧化反应;I2在碱性条件下反应/歧化反应 0.71
【解析】
A原子最外层电子数比次外层电子数多2个电子,所以A为C;B的阴离子与C的阳离子电子数之和为20,质子数相差3,则B为O,C为Na;气体DB2中D的质量分数为50%,则D为S;A、B、C、D、E、F是原子序数依次增大的六种常见元素,E2、EB2均是生活生产中常见的杀菌消毒剂,则E为Cl; A与F形成一种化合物M可与水反应生成一种可燃性的直线型分子N,则F为Ca,以此分析解答。
(1)根据上述分析可知:D为S,E为Cl,根据非金属间的置换反应可以证明非金属性强弱,如![]() ,说明非金属性S<Cl,答案:
,说明非金属性S<Cl,答案:![]() ;
;
(2) 根据上述分析可知:A为C,F为Ca,A与F形成一种化合物M为CaC2,其电子式![]() ;答案:
;答案:![]() ;
;
(3)汽车安仝气囊中的叠氮化钠NaN3可和次氯酸钠溶液发生氧化还原反应生成氮气、氯化钠和水,反应的化学方程式为:![]() ,由2NaN3
,由2NaN3![]() 2
2![]() 2e-mol,则每生成1molN2,转移的电子数为
2e-mol,则每生成1molN2,转移的电子数为![]() ,
,![]() :
:![]() ;
;![]() ;
;
(4) ①根据上述分析可知:EB2为ClO2,用于自来水厂杀菌消毒剂,ClO2与碘化钾溶液发生氧化还原反应,I-被氧化为I2,ClO2被还原Cl-,其离子方程式为![]() ;答案:
;答案:![]() ;
;
②根据![]() 反应原理可知滴定终点的现象是:溶液由蓝色变为无色,半分钟内不恢复为蓝色,答案:溶液由蓝色变为无色,半分钟内不恢复为蓝色;
反应原理可知滴定终点的现象是:溶液由蓝色变为无色,半分钟内不恢复为蓝色,答案:溶液由蓝色变为无色,半分钟内不恢复为蓝色;
③因为![]() 在酸性条件下反应歧化反应,所以步骤Ⅰ中需将溶液调节至中性,答案:
在酸性条件下反应歧化反应,所以步骤Ⅰ中需将溶液调节至中性,答案:![]() 在酸性条件下反应歧化反应;
在酸性条件下反应歧化反应;
④根据![]() 和
和![]() 反应可知:
反应可知:
2ClO2![]() I2
I2![]() S2O32-,n(ClO2)=0.0025
S2O32-,n(ClO2)=0.0025![]() 0.021
0.021![]() ;c(ClO2)=
;c(ClO2)=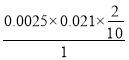 =1.05
=1.05![]() 10-5mol/L=1.05
10-5mol/L=1.05![]() 10-5mol
10-5mol![]() 67.5g/mol=7.1
67.5g/mol=7.1![]() 10-4g/mol=0.71 mg/L,答案:0.71。
10-4g/mol=0.71 mg/L,答案:0.71。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
根据K的变化,结合已有知识推测,随着卤素原子核电荷数的降低,下列说法不正确的是
A.在相同条件下,平衡时X2的转化率逐渐升高
B.X2与H2反应的剧烈程度逐渐减弱
C.HX的还原性逐渐减弱
D.HX的生成为放热反应,由此可知t1<t2