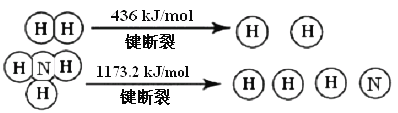
题目内容
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
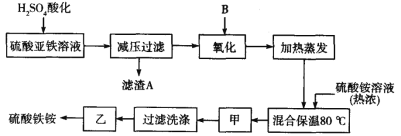
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4 酸化的主要目的是____________,滤渣 A的主要成分是______________。
(2)下列物质中最适合的氧化剂 B 是____________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲_____________,乙_____________。
(4)上述流程中,有一处不严密,请指出并修改_____________。
(5)检验硫酸铁铵中NH4+的方法是_____________。
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,向其中一份 中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应。则该硫酸铁铵的化学式为_____________。
【答案】抑制Fe2+的水解 CaSO4 b 冷却结晶 常温晾干 氧化后和加热蒸发前需检验Fe2+是否全部被氧化 在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,观察到试纸变蓝 Fe2(SO4)3·2(NH4)2SO4·2H2O
【解析】
原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后向滤液中加入过氧化氢氧化可生成硫酸铁;加入硫酸铵在80℃下反应可生成硫酸铁铵,经过蒸发浓缩、冷却结晶、过滤洗涤、常温晾干可得到纯净的硫酸铁铵,据此分析。
(1)硫酸亚铁溶液中Fe2+水解显酸性,加入硫酸抑制Fe2+的水解;同时硫酸根浓度增大,结合Ca2+生成CaSO4沉淀,答案为:抑制Fe2+的水解;CaSO4;
(2)为避免引入新的杂质,应该加入H2O2,因为其还原产物是水,答案为:b;
(3) 在80℃下反应可生成硫酸铁铵,经过蒸发浓缩、冷却结晶、过滤洗涤、常温晾干可得到纯净的硫酸铁铵,温度不能过高,防止其分解,答案为:冷却结晶;常温晾干;
(4)为提高产品的纯度,在加热蒸发之前要检验Fe2+是否全部被氧化, 答案为:氧化后和加热蒸发前需检验Fe2+是否全部被氧化;
(5)检验NH4+的方法是加入强碱溶液,加热能够产生使湿润的红色石蕊试液变蓝的气体,从而证明原溶液中含有NH4+,答案为:在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,观察到试纸变蓝;
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,说明每一份的样品质量为7g;向其中一份中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀,沉淀为Fe(OH)3,物质的量为![]() ,即Fe2(SO4)3的物质的量0.01mol;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应,生成BaSO4,则
,即Fe2(SO4)3的物质的量0.01mol;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应,生成BaSO4,则![]() 的物质的量为0.05mol,Fe2(SO4)3中有0.03mol
的物质的量为0.05mol,Fe2(SO4)3中有0.03mol![]() ,则(NH4)2SO4中有0.02mol
,则(NH4)2SO4中有0.02mol![]() ,(NH4)2SO4的物质的量为0.02mol;一份样品中水的质量
,(NH4)2SO4的物质的量为0.02mol;一份样品中水的质量![]() ,水的物质的量为0.02mol;则
,水的物质的量为0.02mol;则![]() ,化学式为: Fe2(SO4)3·2(NH4)2SO4·2H2O。
,化学式为: Fe2(SO4)3·2(NH4)2SO4·2H2O。

 阅读快车系列答案
阅读快车系列答案