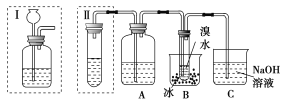
题目内容
【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
根据K的变化,结合已有知识推测,随着卤素原子核电荷数的降低,下列说法不正确的是
A.在相同条件下,平衡时X2的转化率逐渐升高
B.X2与H2反应的剧烈程度逐渐减弱
C.HX的还原性逐渐减弱
D.HX的生成为放热反应,由此可知t1<t2
【答案】B
【解析】
A. 在相同条件下,随着卤素原子核电荷数的降低,K值增大,说明反应的正向程度越大,即X2的转化率越高,故A正确;
B. 随着卤素原子核电荷数的降低,卤元素的非金属性增强,X2与H2反应的剧烈程度逐渐增强,故B错误;
C. 随着卤素原子核电荷数的降低,卤元素的非金属性增强,HX的还原性逐渐减弱,故C正确;
D. X2(g)和H2反应生成HX为化合反应,化合反应通常是放热反应,所以HX的生成为放热反应,升高温度平衡逆向移动,化学平衡常数减小,由表中数据可知同一反应t1的平衡常数>t2的平衡常数,则t1<t2,故D正确;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:i.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Cr3+ |
开始沉淀的pH | 1.5 | 4.9 |
沉淀完全的pH | 2.8 | 6.8 |
回答下列问题:
(1)滤渣①的主要成分为_________(填化学式)。
(2)"氧化”步骤中发生反应的离子方程式为____________。
(3)“加热"操作的目的是_________。
(4)“酸化"过程中发生的反应为2CrO42- +2H+![]() Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
(5)可利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示:
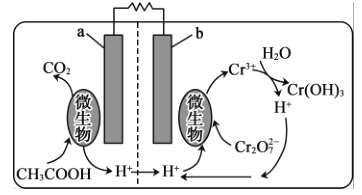
在该电池中,b作______极,a极的电极反应为__________
(6)K2 Cr2O7标准溶液还可用于测定市售硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol -1)的纯度。测定步骤如下:
i.溶液配制:称取1.2400g市售硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后.全部转移至100mL容量瓶中.加蒸馏水至刻度线。
ii.滴定:取0.01000 mol. L-1的K2Cr2 O7标准溶液20. 00 mL,稀硫酸酸化后加入过量KI溶液,发生反应(Cr2O72-被还原成Cr3+ ,I-被氧化成I2)。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32 - =S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液蓝色褪去.即为终点。平行滴定3次,样品溶液的平均用量为25.00mL。
①稀硫酸酸化的K2Cr2O7标准溶液与KI溶液反应的离子方程式为_________
②该市售硫代硫酸钠晶体样品的纯度为_______%(保留1位小数)。