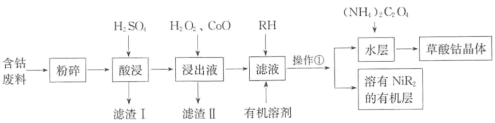
题目内容
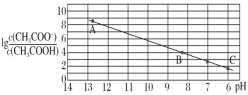
【题目】25 ℃时,将 0.10 mol·L-1 CH3COOH 溶液滴加到 10 mL 0.10 mol·L-1 NaOH 溶液中,lg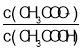 与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
A.pH=7 时加入的醋酸溶液的体积大于 10 mL
B.C 点后继续加入醋酸溶液,水的电离程度减小
C.B 点存在 c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D.Ka(CH3COOH)=10-4.3
【答案】C
【解析】
A.CH3COONa是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则CH3COOH应该稍微过量,酸碱浓度相等,所以酸体积大于碱体积,即酸体积大于10mL,故A正确;
B.C点lg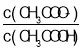 >0,则c(CH3COO-)>c(CH3COOH),继续加入CH3COOH,醋酸浓度越大,水的电离程度越小,所以C点后继续加入醋酸溶液,水的电离程度减小,故B正确;
>0,则c(CH3COO-)>c(CH3COOH),继续加入CH3COOH,醋酸浓度越大,水的电离程度越小,所以C点后继续加入醋酸溶液,水的电离程度减小,故B正确;
C.B点溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),B点c(OH-)>10-6mol/L、c(H+)<10-8mol/L,则c(Na+)-c(CH3COO-)═c(OH-)-c(H+)>(10-6-10-8)molL-1,故C错误;
D.C点lg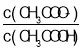 =1.7,pH=6,c(H+)=10-6mol/L,Ka(CH3COOH)═
=1.7,pH=6,c(H+)=10-6mol/L,Ka(CH3COOH)═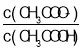 ×c(H+)=101.7×10-6=10-4.3,故D正确;
×c(H+)=101.7×10-6=10-4.3,故D正确;
故选C。

 字词句段篇系列答案
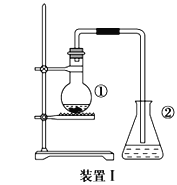
字词句段篇系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
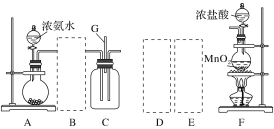
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
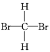
第一步:CH3CH2OH![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
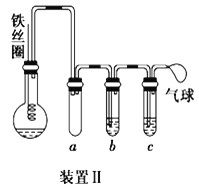
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:______。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是______。
(4)在装置C中应加入____ (填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___ (填“上”或“下”)层。
(6)若产物中有少量副产物乙醚,可用____的方法除去。
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:___。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为___(填字母)。
a.加入过量的氨水
b.通入过量的CO2
c.加入过量的NaOH
d.加入适量的HCl
e.洗涤
f.过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___。
②若用浓HNO3溶解金属硫化物,缺点是___(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
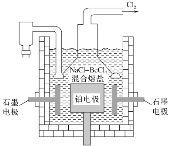
①石墨电极上的电极反应式为___。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |