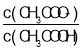题目内容
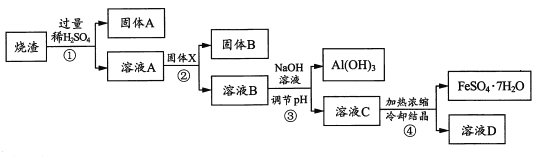
【题目】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
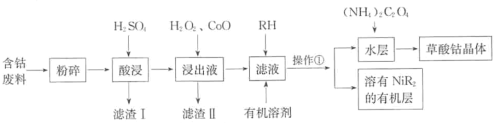
已知:①草酸钴晶体难溶于水:②RH为有机物(难电离)。
回答下列问题:
(1)酸浸时钴溶解反应的化学方程式为_______,浸出液中加入H2O2后发生反应的离子方程式为______。
(2)加入氧化钴的目的是_______,滤渣的II主要成分是_______。
(3)操作①为____________(填操作名称)。
(4)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H ++HC2O 4- Ka1=5.4×10-2
H ++HC2O 4- Ka1=5.4×10-2
HC2O4-![]() H ++C2O42- Ka2=5.4×10-5
H ++C2O42- Ka2=5.4×10-5
该流程中所用(NH4)2C2O4溶液的pH_________(填“>”“<"或"一")7.
(5)钴的含氧酸盐受热分解最终产物多为氧化物,已知18.3g CoC2O4·2H2O热分解质量变化过程如图所示(其中600 °C以前是隔绝空气加热,6000 °C以后是在空气中加热),A、B、C均为纯净物。

①A点对应物质的化学式为________________
②B →C反应的化学方程式为____________________。
【答案】Co + H2SO4 = CoSO4 +H2↑ 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O 调节溶液的pH,沉淀Fe3+和Al3+ Fe(OH)3、Al(OH)3 萃取分液 < CoC2O4 6CoO + O2 ![]() 2Co3O4
2Co3O4
【解析】
含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)与硫酸反应生成硫酸钴、硫酸亚铁、硫酸铝和硫酸镍,二氧化硅不反应,过滤,滤渣为二氧化硅,滤液先加入双氧水氧化亚铁离子变为铁离子,加入氧化钴调节溶液的pH值,沉淀铁离子和铝离子,过滤,向滤液中加入RH和有机溶剂,萃取分液除掉Ni2+,向水层中加入草酸铵得到草酸钴晶体。
⑴酸浸时钴溶解是钴和硫酸反应生成硫酸钴和氢气,反应的化学方程式为Co + H2SO4 = CoSO4 +H2↑,浸出液中加入H2O2主要是亚铁离子被H2O2氧化变为铁离子,反应的离子方程式为2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O;故答案为:Co + H2SO4 = CoSO4 +H2↑;2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O。
⑵加入氧化钴,发生CoO + 2H+ = Co2+ + H2O,调节溶液的pH,使Fe3+和Al3+转化为沉淀,根据前后联系得出滤渣的II主要成分是Fe(OH)3、Al(OH)3;故答案为:调节溶液的pH,沉淀Fe3+和Al3+;Fe(OH)3、Al(OH)3。
⑶根据有机层与水层得出操作①为萃取分液;故答案为:萃取分液。
⑷该流程中所用(NH4)2C2O4溶液,铵根水解显酸性,草酸根水解显碱性,谁的水解程度越大显谁的性质,NH4+的![]() ,C2O42的
,C2O42的![]() ,则NH4+的水解程度大于C2O42的水解程度,溶液显酸性,因此pH<7;故答案为:<。
,则NH4+的水解程度大于C2O42的水解程度,溶液显酸性,因此pH<7;故答案为:<。
⑸18.3g CoC2O4·2H2O物质的量为0.1mol,加热时先失去结晶水,若全部转化为CoC2O4,则固体质量为14.7g,故A为CoC2O4,继续加热,如果完全反应,可得到0.1molCoO(质量为7.5g),故B点为CoO,600 °C以后是在空气中加热,由固体质量增加可知,有空气中的成分进入固体,则CoO与空气中氧气反应,8.03g固体中Co的物质的量为0.1mol,质量为5.9g,所以氧的质量为2.13g,则氧的物质的量为0.133mol,由两者的物质的量之比可得C为Co3O4,B到C的反应方程式为6CoO + O2 ![]() 2Co3O4;故答案为:CoC2O4;6CoO + O2
2Co3O4;故答案为:CoC2O4;6CoO + O2 ![]() 2Co3O4。
2Co3O4。