题目内容
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1)第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3)N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有____个伸展方向。
(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=__________________g· cm-3(用含α、NA的代数式表示)。

【答案】 3 SiO32- [或(SiO3)n2n-] sp3 p 3 6 2 8 ![]()
【解析】(1)元素的非金属性越强,元素的电负性数值越大,同一周期,从左到右,元素的非金属性逐渐增强,电负性数值逐渐增大,第二周期元素的电负性按由小到大的顺序排列,B元素排在第3位,故答案为:3;
(2)Si原子形成四个σ键,Si原子的杂化形式为sp3,根据图片知,每个三角锥结构中Si原子是1个,O原子个数=2+2×![]() =3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n-(或SiO32-),故答案为:SiO32-[或(SiO3)n2n-];sp3;
=3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n-(或SiO32-),故答案为:SiO32-[或(SiO3)n2n-];sp3;
(3)N元素,核外电子排布式为1s22s22p3,位于元素周期表的p区;基态原子中能量最高的电子,处于2p能级,其电子云在空间有3个方向,原子轨道呈纺锤形,故答案为:p;3;
(4)①1个Co离子有6个NH3分子作配体,每个配体提供1对孤对电子,故1个Co离子需要提供6个空轨道,故答案为:6;
②由信息[Co(NH3)6]3+的几何构型为正八面体形,Co在中心可以推知,如果两个NH3分子换成两个Cl-,可以替换邻位和对位,共有两种不同的结构形式,故答案为:2;
(5)①根据均摊法可知,O位于边上,其数目为:12×![]() =3,Ca位于体心,其数目为1,Ti位于顶点,其数目为8×
=3,Ca位于体心,其数目为1,Ti位于顶点,其数目为8×![]() =1,故该矿物的化学式为:CaTiO3,由晶胞结构可知,与1个Ca紧邻的Ti有8个,根据二者的数目比为1:1,与1个Ti紧邻的Ca也有8个,故答案为:8;
=1,故该矿物的化学式为:CaTiO3,由晶胞结构可知,与1个Ca紧邻的Ti有8个,根据二者的数目比为1:1,与1个Ti紧邻的Ca也有8个,故答案为:8;
②根据晶胞结构可知,Ca与O之间的最短距离为面对角线的一半,则晶胞棱长为![]() pm=
pm=![]() ×10-10cm,则晶胞的密度=
×10-10cm,则晶胞的密度=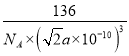 g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() 。
。

【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
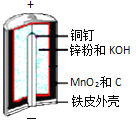
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
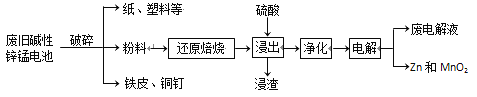
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。