��Ŀ����
����Ŀ������п�̵�����ճ����������������ĵ�أ��乹����ͼ��ʾ��
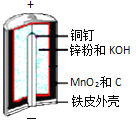
�ŵ�ʱ�ܷ�ӦΪ��Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ������£�
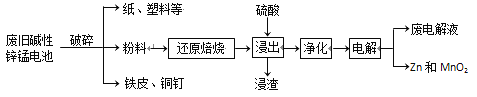
�ش��������⣺
��1��MnOOH�У�MnԪ�صĻ��ϼ�Ϊ________��
��2������ԭ���ա������У��۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO������Ҫԭ���ǡ����ϡ��к���________��
��3������������Ϊ�˳�ȥ����Һ�е�Fe2+�������ǣ�����________���ѧʽ����Һ��Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ������������Ũ��С��1��10��5mol��L��1��Ϊ������ȫ����֪����Һ��Mn2+��Zn2+��Ũ��ԼΪ0.1 mol��L��1�������������ݼ������pH�ĺ�
������________��________��
������ | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP����ֵ | 10��13 | 10��17 | 10��38 |
��4������⡱ʱ�������ĵ缫��ӦʽΪ_____����������Ӧѭ�����õ�������_____���ѧʽ����
��5�����������ϡ�ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2�������ϡ��е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ________��
��6��ij����п�̵��ά�ֵ���ǿ��0.5A���൱��ÿ��ͨ��5��10��6 mol���ӣ�����������80���Ӽ��ӽ�ʧЧ���������һ�ڵ�������п��Ϊ6 g������ʧЧʱ����________%�Ľ���пδ�μӷ�Ӧ��
���𰸡� +3 C ![]() 3 6
3 6 ![]()
![]()
![]() 87
87
��������(1)���ݻ��ϼ۴�����Ϊ0��MnOOH�У�MnԪ�صĻ��ϼ�Ϊ+3�ۣ�
(2)�Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ���ա������У�̼���۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)���ʴ�ΪC��
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2+������H2O2��Һ���������Խ�Fe2+����ΪFe3+������Mn(OH)2��Zn(OH)2��KSP����ֵ�����Mn2+��Zn2+��ʼ����ʱ��������Ũ�ȷֱ�Ϊ![]() =10-6����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ
=10-6����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ![]() =10-11����Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3-6��ʹFe3+��ȫ������Mn2+��Zn2+��������
=10-11����Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3-6��ʹFe3+��ȫ������Mn2+��Zn2+��������
(4)�������Mn2+ʧ���ӷ���������Ӧ����MnO2�������ĵ缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+������Zn2+�õ��ӷ�����ԭ��Ӧ����Zn���ϵ��ҺΪ���ᣬ������Ӧѭ�����õ�������H2SO4���ʴ�Ϊ��Mn2+-2e-+2H2O=MnO2+4H+��H2SO4��
(5)�����ϡ��е�MnOOH���������ԣ������ᷢ��������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ2MnOOH+6HCl![]() 2MnCl2+4H2O+Cl2����
2MnCl2+4H2O+Cl2����
(6)80����ת�Ƶ��ӵ����ʵ���Ϊ5��10-6 mol��80��60=0.024mol�������ĵ�Zn������Ϊ![]() ��65g/mol=0.78g�������������һ�ڵ�������п��Ϊ6g������ʧЧʱ����
��65g/mol=0.78g�������������һ�ڵ�������п��Ϊ6g������ʧЧʱ����![]() ��100%=87%�Ľ���пδ�μӷ�Ӧ��
��100%=87%�Ľ���пδ�μӷ�Ӧ��

 53���ò�ϵ�д�
53���ò�ϵ�д�

