题目内容
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
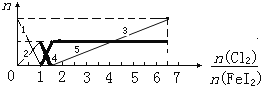
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
【答案】Zn(或锌) 正极锌与还原出的铜构成铜锌原电池而加快锌的腐蚀B防止电解液污染土壤和金属材料的浪费0.2molFe3+IO3-20:3
【解析】
根据原电池的工作原理,根据除杂的基本要求,结合环保思想可解答第Ⅰ问;根据常见粒子的氧化性、还原性的强弱去思考反应的顺序,利用已知信息结合图象,确定溶液中存在的粒子种类,由电子转移守恒可得出正确答案。
Ⅰ:(1)根据原电池的工作原理,较活泼金属作负极,所以Zn—MnO2干电池的负极材料是Zn(或锌);电池工作时,电子从负极流出,经导线流向正极;(2)锌比铜活泼,锌与置换出来的铜构成原电池,锌作负极,因此加快了锌的腐蚀;欲除去Cu2+,最好选用金属锌,防止引入杂质;(3)废旧电池采用回收的处理方法是为了防止电解液污染土壤和地下水源,同时可回收金属材料;(4)若有6.5g锌溶解,即0.1mol锌,则电路中流过电子的物质的量为0.2mol。较理池的构成条件和
Ⅱ:已知微粒的还原性强弱为I->Fe2+,当n(Cl2):n(FeI2)=1时,发生的反应为Cl2+2I-=2 Cl-+I2,当n(Cl2):n(FeI2)=1.5时,发生的反应为3Cl2+2Fe2++4I-=2Fe3++6Cl-+2I2。(1)对照图象分析可知粗线5代表Fe3+的物质的量变化情况,由于Cl2的氧化性强,当溶液中没有I-时,Cl2把I2氧化为IO3-等,而细线3是在n(Cl2):n(FeI2)>1.5时才生成的,因此代表的是IO3-物质的量变化情况;(2)当n(Cl2):n(FeI2)=6时,由图象可知,溶液中含有的粒子是Cl-、Fe3+、I2和IO3-,设n(Cl2)=6amol,则n(FeI2)=amol,设生成的n(IO3-)=xmol,则生成的n(I2)=(2a-x)/2mol,由电子转移守恒可知,Cl2在反应中生成Cl-,得到的电子为12amol,Fe2+转变为Fe3+,失去的电子为amol,生成IO3-失去的电子为6xmol,生成I2失去的电子为(2a-x)mol,则有12amol=amol+6xmol+(2a-x)mol,x=1.8amol,所以n(Cl-):n(IO3-)=12a/1.8a=20:3。

 名校课堂系列答案
名校课堂系列答案