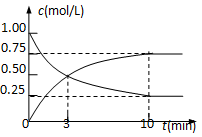
题目内容
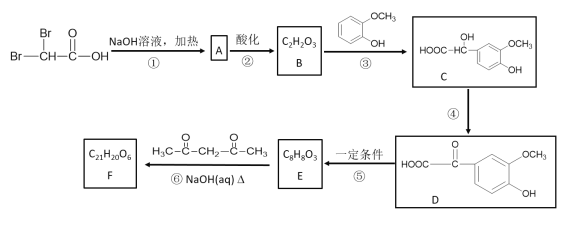
【题目】有机物F(C21H20O6)在临床医学上具有预防肿瘤的作用,其合成路线如下:其中反应③中反应物的原子利用率为100%。
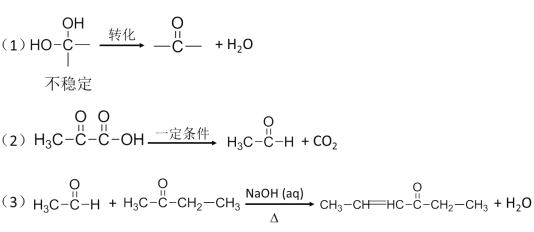
已知:
请回答下列问题:
(1)B中含有的官能团名称是___________。③的反应类型为__________。
(2)反应①的化学方程式是________________。反应④的化学方程式是___________。
(3)E的结构简式是______________。F的结构简式是__________________。
(4)E的同分异构体中,同时符合下列两个条件的共有种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为______________。
①苯环上的一取代物只有2种;
②1 mol该物质与足量NaOH溶液反应时,反应消耗3 mol NaOH
【答案】(1)醛基、羧基,取代反应;
(2)![]() +3NaOH
+3NaOH![]()
![]() +2NaBr+2H2O;
+2NaBr+2H2O;
2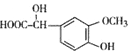 +O2
+O2![]() 2
2![]() +2H2O;
+2H2O;
(3) 、
、 ;
;
(4)5; 。
。
【解析】
试题分析:反应①在碱性条件下发生卤原子的水解,根据信息(1),则A的结构简式为:![]() ,反应②酸化,利用酸性强的制取弱的,则B的结构简式为:
,反应②酸化,利用酸性强的制取弱的,则B的结构简式为:![]() ,D的分子式为C9H8O5,对比D和E的结构简式,以及根据(2),反应⑤去掉一个CO2,(1)根据上述推断,B中含有的官能团是醛基和羧基,B、C结构简式的对比,发生的反应类型是加成反应;(2)反应①是卤原子的水解反应和中和反应,以及信息(1),其反应方程式为:
,D的分子式为C9H8O5,对比D和E的结构简式,以及根据(2),反应⑤去掉一个CO2,(1)根据上述推断,B中含有的官能团是醛基和羧基,B、C结构简式的对比,发生的反应类型是加成反应;(2)反应①是卤原子的水解反应和中和反应,以及信息(1),其反应方程式为:![]() +3NaOH
+3NaOH![]()
![]() +2NaBr+2H2O;对比C、D结构简式,发生的是氧化反应,即反应④的方程式为2
+2NaBr+2H2O;对比C、D结构简式,发生的是氧化反应,即反应④的方程式为2 +O2
+O2![]() 2
2![]() +2H2O;(3)反应⑤是利用信息(2)失去一个CO2,其E的结构简式为:
+2H2O;(3)反应⑤是利用信息(2)失去一个CO2,其E的结构简式为: ,利用信息(3)F的结构简式为:
,利用信息(3)F的结构简式为: ;(4)有4组吸收峰,说明有4种不同化学环境的氢原子,苯环上的一氯代物有2种,说明是对称结构,能消耗3molNaOH,则该有机物的结构简式为
;(4)有4组吸收峰,说明有4种不同化学环境的氢原子,苯环上的一氯代物有2种,说明是对称结构,能消耗3molNaOH,则该有机物的结构简式为 。
。

【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
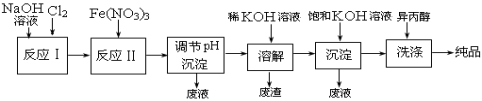
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
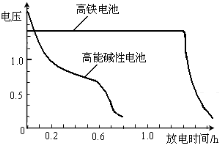
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。