题目内容
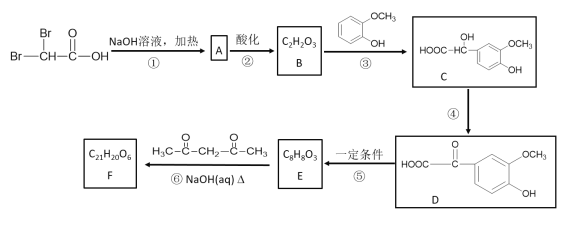
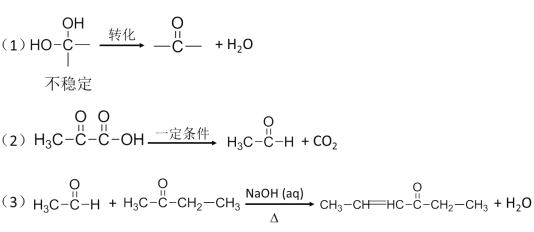
【题目】锰的化合物种类较多,也大多具有广泛的用途。
I. MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:

①从以上实验中,我们可以得出的结论是_________________________________。
②写出C试管中发生反应的离子方程式:_________________________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH为上表所示。
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_____________________。
②步骤二中需控制pH的范围是 ___________ 。
③步骤三中是否洗涤干净的判断方法是 _______________ 。
【答案】Ⅰ.(1)D;(2)①酸性越强,MnO2的氧化能力越强;②MnO2+4H++2I-=Mn2++I2+2H2O;
Ⅱ. ①2∶1;②pH≥10.4;③最后的洗涤液呈中性。
【解析】
试题分析:I.(1)A、MnO2只跟浓盐酸反应且需要加热,故错误;B、MnO2作催化剂,不是氧化剂,故错误;C、BaSO3也是白色沉淀,故错误;D、如果溶液变为血红色,说明MnO2的氧化性,故正确;(2)①根据表格中的数据,在酸性条件下溶液迅速变为棕褐色,说明I-迅速被氧化成I2,因此得出结论是:酸性越强,MnO2的氧化能力越强;②I-→I2化合价升高1价,MnO2中Mn由+4价→+2价降低2价,最小公倍数为2,则I-系数为2,MnO2的系数为1,然后根据电荷守恒和元素守恒,配平其他,因此离子反应方程式为:MnO2+4H++2I-=Mn2++I2+2H2O;II.①根据铁酸锰的化学式MnFe2O4,以及元素守恒,推出两者物质的量之比为2:1;②根据工艺流程,需要保证Fe3+、Mn2+全部转化成沉淀,因此调节pH≥10.4;③沉淀表面是KOH,因此检验沉淀是否洗净,检验溶液是否是中性,因此是:最后的洗涤液呈中性。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
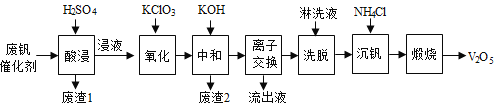
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为________________________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为_____________mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有______________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。