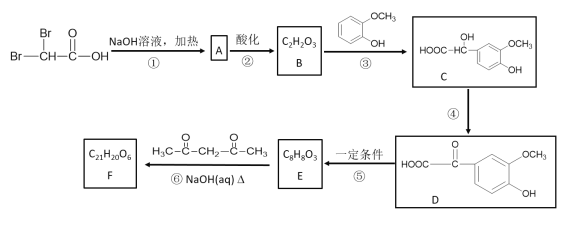
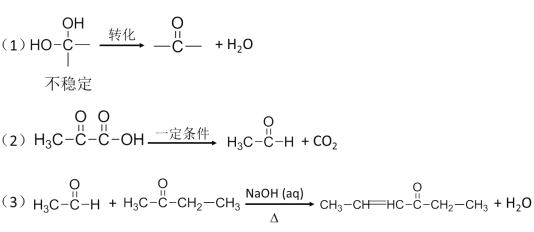
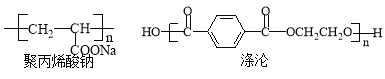
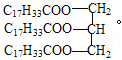题目内容
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
![]()
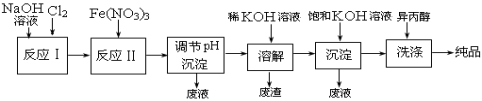
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
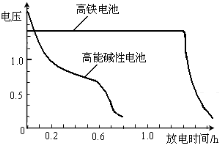
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。
【答案】(1)①2NaOH+Cl2=NaCl+NaClO+H2O;②3ClO- + 10OH- + 2Fe3+ = 2FeO42- + 3Cl- + 5H2O;③增大K+浓度,促进K2FeO4晶体析出;(2)高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3胶体有吸附性,可除去悬浮杂质;(3)3:1;(4)放电时间长;工作电压稳定。
【解析】
试题分析:(1)①反应I中氯气和NaOH发生歧化反应,反应方程式为Cl2 + 2NaOH = NaCl + NaClO + H2O;②根据湿法Fe化合价由+3价→+6价,升高3价,ClO-中Cl由+1价→-1价降低2价,最小公倍数6,因此Fe3+的系数为2,ClO-的系数为3,根据原子守恒和电荷守恒,2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;③增大K+浓度,促进K2FeO4晶体析出;
(2)+6价Fe具有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能除去吸附杂质,达到净水;(3)根据干法,反应方程式为Fe2O3 + 3KNO3 + 4KOH ![]() 2K2FeO4 + 3KNO2 + 2H2O,Fe2O3是还原剂,KNO3是氧化剂,因此氧化剂和还原剂的物质的量之比为3:1;
2K2FeO4 + 3KNO2 + 2H2O,Fe2O3是还原剂,KNO3是氧化剂,因此氧化剂和还原剂的物质的量之比为3:1;
(4)根据放电曲线,得出优点:放电时间长;工作电压稳定。