题目内容
【题目】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 | Al | B | Be | C | Cl | F | Li |
X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | Na | O | P | S | Si | |
X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K ______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________。
Ⅱ.(1)
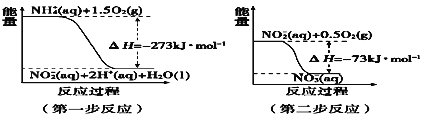
①第一步反应是____反应(选填“放热”或“吸热”),判断依据_____。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
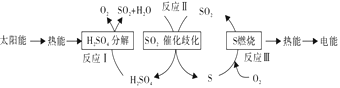
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=297 kJ/mol
反应Ⅱ的热化学方程式:_______________。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH的量 | 放出的热量 |
22.0 g | 750 mL 1.0 mol/L | x kJ |
1.0 mol | 2.0 L 1.0 mol/L | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________。
【答案】> 共价键 N 原子半径越小,X的数值越大 放热 ΔH=-273kJ/mol<0 (或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)ΔH=-346 kJ/mol 3SO2(g)+2H2O(g)= 2H2SO4(l)+S(s) ΔH2=-254 kJ/mol NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ/mol
【解析】
I.(1)元素的金属性越强,X的数值,结合同一主族元素的金属性变化规律分析判断;
(2)根据表格中Al的X数值为1.5,Cl的X数值为2.8,则Br的X数值比2.8还小,计算二者的X值的差值,然后与1.7比较,然后再进行判断;
(3)先判断元素的非金属性强弱,然后根据共用电子对偏向吸引电子能力强的一方确定;
(4)结合第三周期元素的原子序数与X数值关系,利用元素周期律分析判断;
II.(1)①根据反应物、生成物的能量大小判断反应的热效应;
②1molNH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到相应的热化学方程式;
(2)利用盖斯定律,将I+III,整理可得II的热化学方程式;
(3)根据题意可知,22gCO2通入1mol/LNaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol/LNaOH溶液2L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式。
(1)根据表格数据可知:元素的金属性越强,X的数值越小。由于K、Rb是同一主族的元素,元素的金属性K比Rb弱,所以元素的X的数值K>Rb;
(2)由表格中数据可知:Al的X数值为1.5,Cl的X数值为2.8,则Br的X数值比2.8还小,故Al、Br的X数值之差小于1.7,因此二者形成的化学键为共价键;
(3) S的X数值为2.5,N的非金属性大于C(X的数值为2.5),则N的X数值大于S的X数值,即N的非金属性大于S的非金属性,即共用电子对偏向吸引电子能力强的N元素一方;
(4)根据表格中第三周期元素可知:原子序数越大,原子半径越小,元素的X数据就越大,因此第二周期的元素也重复第三周期的变化规律,即:元素的原子序数越大,原子半径越小,元素的X的数值也越大;
II.(1)①根据图示可知反应物的能量比生成物的能量大,因此反应物转化为生成物时会放出热量,该反应为放热反应;判断反应的热效应;
②1molNH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)ΔH=-346 kJ/mol;
(2)将热化学方程式I和III相加,整理可得II的热化学方程式:3SO2(g)+2H2O(g)= 2H2SO4(l)+S(s) ΔH2=-254 kJ/mol;
(3)根据题意,22gCO2通入1mol/LNaOH溶液750mL中充分反应,n(CO2)=22g÷44g/mol=0.5mol,n(NaOH)=1mol/L×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH=NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为①2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4xkJ/mol,又1mol CO2通入2mol/LNaOH溶液2L中充分反应放出ykJ的热量,则热化学方程式为②2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l) △H=-ykJ/mol,由盖斯定律可知,①-②可得,NaOH(aq)+ CO2(g)=NaHCO3(aq) △H=-(4x-y)kJ/mol。

 名校课堂系列答案
名校课堂系列答案