题目内容
【题目】配制100 mL 1.0 ![]()
![]() 的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
A. 容量瓶使用前经蒸馏水清洗后没有干燥
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 用敞口容器称量NaOH且时间过长
【答案】BD
【解析】
A、容量瓶使用前经蒸馏水清洗后没有干燥留有蒸馏水,由于定容时还需要加入蒸馏水,所以不影响配制结果,选项A不选;B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,根据c=![]() 可知,配制的溶液浓度偏低,选项B选;C、俯视确定凹液面与刻度线相切,会导致加入的蒸馏水体积偏小,根据c=
可知,配制的溶液浓度偏低,选项B选;C、俯视确定凹液面与刻度线相切,会导致加入的蒸馏水体积偏小,根据c=![]() 可知,配制的溶液浓度偏高,选项C不选;D、称量NaOH固体时使用了称量纸,导致氢氧化钠吸水或与空气中二氧化碳反应,导致配制的溶液中溶质的物质的量偏小,根据c=
可知,配制的溶液浓度偏高,选项C不选;D、称量NaOH固体时使用了称量纸,导致氢氧化钠吸水或与空气中二氧化碳反应,导致配制的溶液中溶质的物质的量偏小,根据c=![]() 可知,配制的溶液浓度偏低,选项D选;答案选BD。
可知,配制的溶液浓度偏低,选项D选;答案选BD。

【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
【题目】化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯。
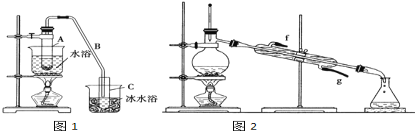
已知:
相对分子质量 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_________.
②试管C置于冰水浴中的目的是____________________________.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静止、分层,环己烯在______层(填“上”或“下”),分液后用_______(填选项字母)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,蒸馏时要加入生石灰,目的是__________________________.
③蒸馏收集产品时,实验制得的环己烯精品质量低于理论产量,可能的原因是_______(填选项字母).
a. 蒸馏时从70℃开始收集产品 b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出。
(3)以下区分环己烯精品和粗品的方法,合理的是_______(填选项字母)。
a. 分别加入用金属钠 b. 分别加入酸性高锰酸钾溶液
c. 分别测定沸点 d. 分别加入FeCl3溶液
(4)如果最终得到纯净环己烯产品质量为8.2 g, 则该实验所得到的环己烯产率是___________(保留3位有效数字)。
【题目】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 | Al | B | Be | C | Cl | F | Li |
X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | Na | O | P | S | Si | |
X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K ______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________。
Ⅱ.(1)
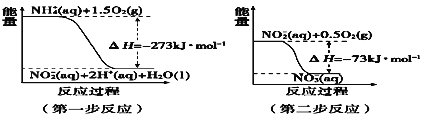
①第一步反应是____反应(选填“放热”或“吸热”),判断依据_____。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
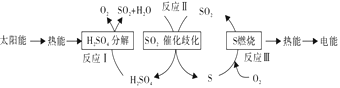
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=297 kJ/mol
反应Ⅱ的热化学方程式:_______________。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH的量 | 放出的热量 |
22.0 g | 750 mL 1.0 mol/L | x kJ |
1.0 mol | 2.0 L 1.0 mol/L | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________。