题目内容
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是

A. 起始滤液常温下pH﹥7 B. 试剂Ⅰ为BaCl2溶液
C. 上图过程必须经2次过滤 D. 步骤③目的是除去CO32-
【答案】C
【解析】
KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再向滤液中加入过量的试剂Ⅰ为BaCl2溶液以除去SO42-,过滤,得到的混合物X中含有KCl、BaCl2,再加过量的试剂Ⅱ为K2CO3以除去Ba2+,过滤,得到的混合物Y中含有KCl、K2CO3,再加适量的试剂Ⅲ为盐酸以除去CO32-,再通过加热浓缩、蒸发结晶得KCl晶体。
A. 起始滤液中含有碳酸钾,碳酸根离子水解使溶液显碱性,pH>7,故A正确;
B. 由上述分析可知,试剂I为BaCl2溶液,故B正确;
C. 样品溶于适量水中,充分搅拌后过滤,选择试剂除去杂质时还需要2次过滤,共3次,故C错误;
D. 步骤③中加入的试剂Ⅲ为盐酸,其目的是除去CO32-,故D正确,答案选C。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
【题目】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 | Al | B | Be | C | Cl | F | Li |
X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | Na | O | P | S | Si | |
X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K ______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________。
Ⅱ.(1)
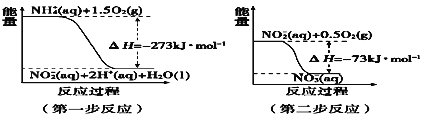
①第一步反应是____反应(选填“放热”或“吸热”),判断依据_____。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
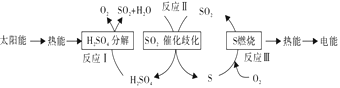
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=297 kJ/mol
反应Ⅱ的热化学方程式:_______________。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH的量 | 放出的热量 |
22.0 g | 750 mL 1.0 mol/L | x kJ |
1.0 mol | 2.0 L 1.0 mol/L | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________。