题目内容
14. 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
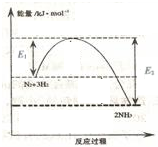
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
分析 (1)由图可知,氮气、氢气总能量高于氨气能量,该反应为放热反应;
(2)①根据v=$\frac{△c}{△t}$计算v(N2),再根据速率之比等于其化学计量数之比计算v(H2);
②由表中数据可知,40min到达平衡,根据氮气的物质的量计算分解的氨气的物质的量,进而计算平衡时氨气的物质的量,再根据c=$\frac{n}{V}$计算平衡时氨气的浓度;
③等效为压强增大一倍,增大压强,反应速率加快.
解答 解:(1)由图可知,氮气、氢气总能量高于氨气能量,该反应为放热反应,
故答案为:放热;
(2)①前20min内,生成氮气为0.016mol,则v(N2)=$\frac{\frac{0.016mol}{2L}}{20min}$=4×10-4mol/(L.min),速率之比等于其化学计量数之比,则v(H2)=3v(N2)=3×4×10-4mol/(L.min)=1.2×10-3mol/(L.min),
故答案为:1.2×10-3mol/(L.min);
②由表中数据可知,40min到达平衡,平衡时分解的氨气的物质的量为0.04mol×2=0.08mol,故平衡时氨气的物质的量为0.1mol-0.08mol=0.02mol,平衡时氨气的浓度为$\frac{0.02mol}{2L}$=0.01mol/L,
故答案为:0.01mol/L;
③在1L密闭容器中加入催化剂并通入0.1mol NH3(g),等效为再原平衡的基础上压强增大一倍,增大压强,容器中的反应速率比原容器的快,
故答案为:快.
点评 本题考查化学反应中能量平衡、化学反应速率计算及影响因素、化学平衡有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
9.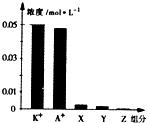 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
19.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质子数相同 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质量数不同,不能互称同位素 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti化学性质不同 |
3.对二甲苯是苯的同系物,也是一种化学工业的重要原料,下列说法正确的是( )
| A. | 对二甲苯的一氯代物有三种 | |
| B. | 对二甲苯的所有原子可能在同一平面内 | |
| C. | 对二甲苯能使溴水和酸性高锰酸钾因发生化学反应而褪色 | |
| D. | 在一定条件下,对二甲苯能发生氧化反应、还原反应、取代反应、加成反应 |
4.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示中,正确的是( )

| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |




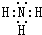 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.