题目内容
15. 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:(1)A点的沉淀物的化学式为Mg(OH)2;B点的沉淀物的化学式为Mg(OH)2、Al(OH)3.
(2)原混合物中MgCl2的质量是1.90g,AlCl3的质量是2.67g,NaOH的质量是5.20g.
(3)Q点HCl溶液加入量是130mL.
分析 向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠.
解答 解:(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
故答案为:Mg(OH)2;Mg(OH)2、Al(OH)3;
(2)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量为:0.02mol×95g/mol=1.90g;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,氯化铝的质量为:0.02mol×133.5g/mol=2.67g;
由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质量为:0.13mol×40g/mol=5.20g
故答案为:1.90;2.67;5.20;
(3)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时:n(NaOH)=n(HCl),则V(HCl)=$\frac{0.13mol}{1mol/L}$═0.13L=130mL,
故答案为:130.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线变化趋势及每段发生的化学反应为解本题关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生达到分析能力及化学计算能力.

| A. | 对二甲苯的一氯代物有三种 | |
| B. | 对二甲苯的所有原子可能在同一平面内 | |
| C. | 对二甲苯能使溴水和酸性高锰酸钾因发生化学反应而褪色 | |
| D. | 在一定条件下,对二甲苯能发生氧化反应、还原反应、取代反应、加成反应 |
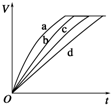 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
①
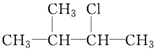 ②CH2Br2 ③
②CH2Br2 ③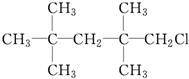 ④CH2═CHBr.
④CH2═CHBr.| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |

| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O | 正确 |
| B | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Fe(OH)3↓ | 正确 |
| C | 在稀氨水中通入过量CO2:NH3•H2O+CO2→NH4++HCO3- | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2→2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
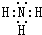 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.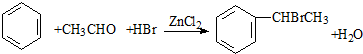 (卤烷基化反应)
(卤烷基化反应)
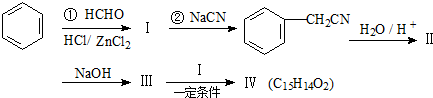
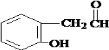 ,
,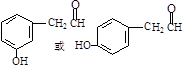 .
.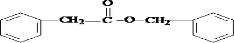 .
.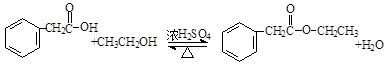 .
.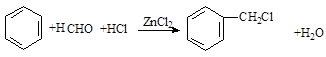 .
.