题目内容
【题目】把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为( )
A.1︰2︰3B.3︰2︰1C.6︰3︰1D.6︰3︰2
【答案】D
【解析】
三个电解槽串联,则转移的电子数相等,设均转移6e-,由Na++e-═Na、Mg2++2e-═Mg、Al3++3e-═Al,则:6e-~6Na~3Mg~2Al,所以析出钠、镁、铝的物质的量之比为6:3:2,故答案为D。

 口算题天天练系列答案
口算题天天练系列答案【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。

I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
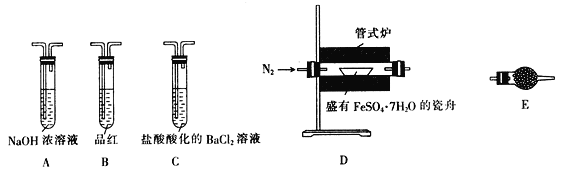
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
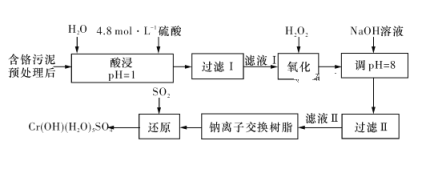
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。