题目内容
【题目】下列各组离子在指定的溶液中,能大量共存的是( ) ①酸性溶液中:Fe2+、Al3+、NO ![]() 、Cl﹣、I﹣
、Cl﹣、I﹣
②pH=13的溶液:Na+、CO ![]() 、SO
、SO ![]() 、AlO
、AlO ![]() 、S2﹣
、S2﹣
③水电离出来的c(H+)=10﹣13mol/L的溶液:NH4+、K+、NO ![]() 、S2O
、S2O ![]()
④加入铝片能放出H2的溶液:Na+、HCO ![]() 、Cu2+、SO
、Cu2+、SO ![]()
⑤滴加石蕊试液显红色的溶液:Fe3+、NH ![]() 、Cl﹣、NO
、Cl﹣、NO ![]() .
.
A.①②
B.②③
C.②④⑤
D.②⑤
【答案】D
【解析】解:①酸性条件下Fe2+、NO ![]() 发生的氧化还原反应,酸性条件下I﹣、NO3﹣发生的氧化还原反应,则一定不能共存,故①错误; ②pH=13的溶液显碱性,该组离子在碱性条件下不反应,则能共存,故②正确;
发生的氧化还原反应,酸性条件下I﹣、NO3﹣发生的氧化还原反应,则一定不能共存,故①错误; ②pH=13的溶液显碱性,该组离子在碱性条件下不反应,则能共存,故②正确;
③水电离出来的c(H+)=10﹣13mol/L的溶液,为酸或碱溶液,碱性溶液中OH﹣与NH ![]() 结合生成弱电解质,酸性溶液中H+与S2O
结合生成弱电解质,酸性溶液中H+与S2O ![]() 发生氧化还原反应,则不能共存,故③错误;
发生氧化还原反应,则不能共存,故③错误;
④加入铝片能放出H2的溶液,为酸或强碱溶液,HCO ![]() 既能与酸反应又能与碱反应,则一定不能共存,故④错误;
既能与酸反应又能与碱反应,则一定不能共存,故④错误;
⑤滴加石蕊试液显红色的溶液,显酸性,该组离子之间不反应,则一定能共存,故⑤正确;
故选D.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: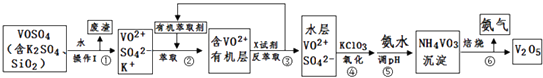
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
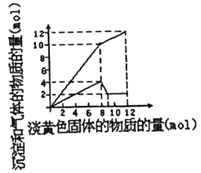
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .