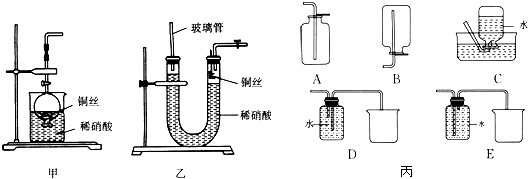
题目内容
【题目】某研究性学习小组同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置:
2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置: 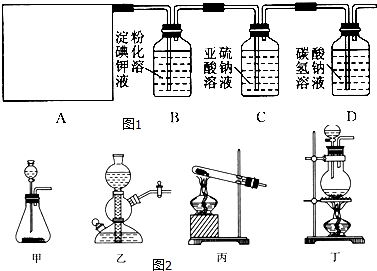
请回答下列问题:
(1)该实验中A部分的装置是图2中的 .
(2)A中发生反应一段时间后,B中的现象是 . B中发生反应的化学方程式为 .
整套实验装置存在的明显缺陷是 .
(3)写出D装置中发生反应的离子方程式 .
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化为Na2SO4(简述实验步骤): .
【答案】
(1)丁
(2)溶液变蓝;2KI+Cl2=2KCl+I2;无尾气吸收装置
(3)Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑
(4)取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化
【解析】解:(1)从方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置,故答案为:丁;(2)氯气具有强的氧化性,碘化钾反应2KI+Cl2═2KCl+I2 , 生成的I2遇到淀粉变蓝色;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;
故答案为:溶液变成蓝色;2KI+Cl2═2KCl+I2;无尾气吸收;(3)D装置中发生两个反应:氯气和水反应、盐酸和碳酸氢钠,反应的离子方程式分别为:Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑,
故答案为:Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑.(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,检验硫酸根离子的存在选用试剂稀盐酸和氯化钡溶液,实验设计如下:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化;
故答案为:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化;
依据实验目的:制取氯气并验证其性质,依据化学方程式为Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O中反应物状态和反应条件选择发生装置,然后依次通入盛有淀粉碘化钾溶液的B、亚硫酸钠溶液的C、碳酸氢钠溶液的D验证氯水的性质,注意氯气有毒,需要进行尾气处理,据此解答;(1)根据反应物的状态及反应条件选择气体的发生装置;(2)氯气具有强的氧化性,与碘化钾反应生成单质碘和氯化钾,单质碘遇淀粉变蓝;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;(3)氯气溶于水和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠反应生成水和二氧化碳;(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化;
2CaSO4+2Cl2↑+2H2O中反应物状态和反应条件选择发生装置,然后依次通入盛有淀粉碘化钾溶液的B、亚硫酸钠溶液的C、碳酸氢钠溶液的D验证氯水的性质,注意氯气有毒,需要进行尾气处理,据此解答;(1)根据反应物的状态及反应条件选择气体的发生装置;(2)氯气具有强的氧化性,与碘化钾反应生成单质碘和氯化钾,单质碘遇淀粉变蓝;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;(3)氯气溶于水和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠反应生成水和二氧化碳;(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化;

 习题精选系列答案
习题精选系列答案【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
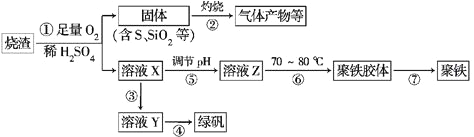
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .