题目内容
5.下列各组物质中,按熔点由高到低的顺序排列正确的是( )| A. | H2O、H2S、H2Se | B. | Hg、Na、NaCl | ||
| C. | 晶体硅、金刚石、碳化硅 | D. | S、Br2、O3 |
分析 首先判断晶体的类型,一般来说晶体的熔点原子晶体>离子晶体>金属晶体>分子晶体,相同晶体从影响晶体熔沸点高低的因素分析:
原子晶体中,晶体的熔点与键长成反比,键长越长,晶体的熔点越低;
离子晶体中,结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
金属晶体中,原子半径依次越小,金属离子电荷越多,金属键就越强强,则熔点就越高;
分子晶体中,结构相似,分子量越大,熔沸点越高,含有氢键的物质熔沸点较高.
解答 解:A.从两个角度考虑,水中存在氢键,沸点最高,H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2O>H2Se>H2S,故A错误;
B.晶体熔沸点高低顺序一般为:原子晶体>离子晶体>分子晶体,氯化钠属于离子晶体、Hg、Na属于金属晶体,Hg常温下为液态,所以熔沸点由高到低的顺序是:金刚石NaCl>Na>Hg,故B错误;
C.金刚石、碳化硅、晶体硅都是原子晶体,且原子间键长大小顺序是硅硅键>碳硅键>碳碳键,所以这三种晶体熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,故C错误;
D.S、Br2、O3都属于分子晶体,都不含有氢键,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,硫有S2、S4、S8等,相对分子质量较大,硫单质常温下为固体,Br2式量160,常温下为液体,O3式量48,常温下为气体,所以熔点由高到低S、Br2、O3,故D正确;
故选D.
点评 本题考查晶体熔点的比较,题目难度不大,注意把握影响不同晶体熔沸点高低的因素,当然也可以依据物质在常温下的状态来比较,学习中注重相关基础知识的积累.

练习册系列答案
相关题目
15.卤化氢(HX)中稳定性最弱的是( )
| A. | HF | B. | HCl | C. | HBr | D. | HI |
16.下列溶液一定显酸性的是( )
| A. | 含H+的溶液 | B. | H+浓度为1×10-6 mol/L的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
20.已知下列热化学方程式:
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
| A. | 438.6 kJ/mol | B. | 241.8 kJ/mol | C. | 285.8kJ/mol | D. | -285.8 kJ/mol |
10.T1温度下,反应2SO2(g)+O2(g)?2SO3(g)△H<0的平衡常数K=532.4.
(1)该反应平衡常数的表达式为K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})c(O{\;}_{2})}$,
T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)=0.0600mol•L-1,c(O2)=0.400mol•L-1,c(SO3)=2.000mol•L-1,此时反应进行的方向为逆反应方向.
(2)该反应△S<0,升高温度,平衡常数减小(填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
1下列能说明T2温度下甲容器中上述反应已达到平衡状态的是AB.
A.SO2、O2、SO3的物质的量浓度之比为212
B.容器内气体压强不再变化
C.单位时间内生成2v(SO2)消耗=v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,α1+α2< 1(填“>”“=”或“<”),T1<T2(填“>”“=”或“<”).
(1)该反应平衡常数的表达式为K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})c(O{\;}_{2})}$,
T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)=0.0600mol•L-1,c(O2)=0.400mol•L-1,c(SO3)=2.000mol•L-1,此时反应进行的方向为逆反应方向.
(2)该反应△S<0,升高温度,平衡常数减小(填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
A.SO2、O2、SO3的物质的量浓度之比为212
B.容器内气体压强不再变化
C.单位时间内生成2v(SO2)消耗=v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,α1+α2< 1(填“>”“=”或“<”),T1<T2(填“>”“=”或“<”).
1.实验室里用下列仪器和药品来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 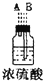 | 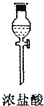 | 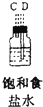 | 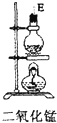 | 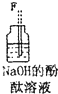 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
19.下列关于溶液和胶体的叙述中正确的是( )
| A. | 溶液中的粒子一定不带电,胶体中的分散质粒子带电荷 | |
| B. | 电泳现象证明胶体带电荷 | |
| C. | 加入电解质,胶体可产生沉淀,而溶液不能 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现光亮的通路,前者则没有 |
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下: