题目内容
9.元素在周期表中的位置反映了元素的原子结构和元素的性质,如图1是元素周期表的一部分.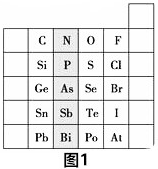
(1)阴影部分元素的外围电子排布式的通式为ns2np3;基态P原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;Se的元素名称为硒.
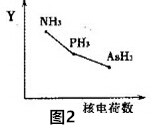
(2)氮族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示,则Y轴可表示的氢化物(RH3)性质有AC.
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(3)氮、硫元素形成的常见的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥形结构的酸是H2SO3.(填化学式)
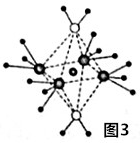
(4)氢、氮、氧、硫、铜这5种元素形成的一种1:1型离子化合物中,阴离子呈正四面体结构,阳离子呈轴向狭长的八面体结构(如图3所示).
该化合物中,阴离子为SO42-,该化合物中加热时首先失去的组分是H2O,判断理由是H2O和Cu2+的配位键比NH3与Cu2+的弱.
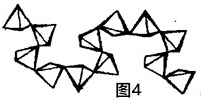
(5)磷酸盐与硅酸盐之间具有几何形态的相似性.如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式.不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体.如图4为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为PO32-(或(PO3)n2n-).
分析 (1)阴影部分元素处于ⅤA族,最外层还有5个电子,据此写出其外围电子排布的通式;根据P所在周期表中位置判断其结构及电子占据的最高层符号;M层还有s、p、d轨道,据此计算还有轨道数;Se的元素名称为硒;
(2)A.非金属性越强,氢化物的稳定性越强;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高;
C.非金属性越强与氢元素形成的共价键越强,键能越大;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是亚硝酸;酸根呈三角锥结构,说明该酸根离子价层电子对个数是4且含有一个孤电子对;
(4)氢、氮、氧、硫、铜这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对;
阳离子中存在共价键和配位键;H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O
(5)SiO44-中价层电子对个数是4且不含孤电子对,利用均摊法计算其原子个数比,从而确定其化学式.
解答 解:(1)阴影部分元素处于ⅤA族,最外层还有5个电子,其外围电子排布的通式为:ns2np3;P核外还有3个电子层,则电子占据的最高层符号为M,M层还有1个s轨道、3个p轨道和5个d轨道,总共还有9个轨道;Se元素为硒,
故答案为:ns2np3;M;9;硒;
(2)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故B错误;
C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;
故答案为:AC;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3,
故答案为:HNO2、HNO3;H2SO3;
(4)氢、氮、氧、硫、铜这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对,为SO42-;
H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱;
(5)根据图片知,每个三角锥结构中P原子是1个,O原子个数=2+2×$\frac{1}{2}$=3,所以P原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个P原子带4个单位正电荷,所以形成离子为[PO3]n2n- (或PO32-),
故答案为:PO32-(或(PO3)n2n-.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确原子结构与元素周期表结构、元素周期律内容的关系为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活运用能力.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案示生成沉淀或微溶化合物,“-”表示观察不到明显现象,“↑”表示有气体产生.
| A | B | C | D | E | |
| A | - | ↓ | ↑ | ↑ | ↓ |
| B | ↓ | - | ↓ | ↓ | - |
| C | ↑ | ↓ | - | - | - |
| D | ↑ | ↓ | - | - | ↓ |
| E | ↓ | - | - | ↓ | - |
(1)B是Ba(OH)2 C是NaHCO3 D是Na2CO3E是BaCl2(填化学式).
(2)写出下列离子反应方程式
①A与E反应的离子方程式:Ba2++SO42-=BaSO4↓;
②将B的溶液逐滴加入C的溶液中直至过量,在此过程中,所发生的离子反应可能有:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,Ba2++CO32-=BaCO3↓;
③将等物质的量浓度、等体积的A、B两溶液混合Ba2++OH-+H++SO42-=BaSO4↓+H2O.
| A. | 反应②说明高温下Sb还原性比C强 | |
| B. | 反应①②中氧化剂分别是Sb2S3、Sb4O6 | |
| C. | 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为1:1 | |
| D. | 反应①中每生成1 mol FeS时,共转移2mol电子 |
| A. | Na2O2所包含的阴阳离子个数比为1:1 | |
| B. | 标准状况下,78gNa2O2与44.8CO2反应转移电子数为NA | |
| C. | 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2足量不同 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
| A. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| B. | 1 mol•L-1 Na2CO3溶液中含有的钠离子数为2NA | |
| C. | 28 g N2中含有的原子数为NA | |
| D. | 1 mol Mg与足量稀盐酸反应,转移的电子数为2NA |
 E.
E.