��Ŀ����
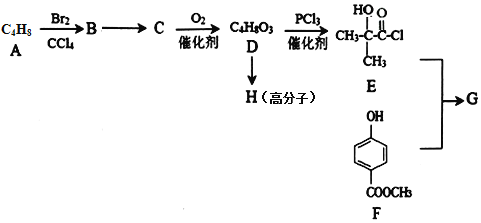
����Ŀ����֪AΪ����ɫ���壬R�ǵؿ��к������Ľ���Ԫ�صĵ��ʣ�TΪ������ʹ����㷺�Ľ������ʣ�D �Ǿ��д��Եĺ�ɫ���壬C��F����ɫ��ζ�����壬H�ǰ�ɫ������W��Һ�еμ�KSCN��Һ���ֺ�ɫ��
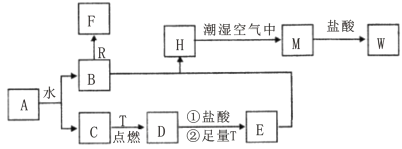
(1)����D�Ļ�ѧʽΪ___________��E��ѧʽΪ___________��
(2)��ȼ����Fǰ������___________________________��
(3)H�ڳ�ʪ�����б��M��ʵ��������______________________________________________����ѧ����ʽΪ_________________________________��
(4)B��R����Һ�з�Ӧ����F�����ӷ���ʽΪ___________________________________��
���𰸡�Fe3O4 FeCl2 �������崿�� ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2Al+2OH+2H2O=2AlO2��+3H2��
��������
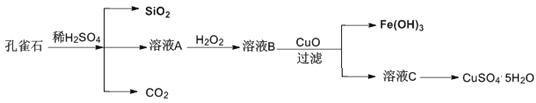
����ת����ϵ�ͷ�Ӧ������AΪ����ɫ����������ˮ��Ӧ������AΪNa2O2��TΪ������ʹ����㷺���Ľ������ʣ���TΪFe��R�ǵؿ��к������Ľ���Ԫ�صĵ��ʣ���RΪAl��D�Ǿ��д��Եĺ�ɫ���壬��DΪFe3O4��C��F����ɫ��ζ�����壬H�ǰ�ɫ������W��Һ�еμ�KSCN��Һ���ֺ�ɫ����W���������ӣ�����������ˮ��Ӧ����B��C������C��Ӧ����Fe3O4������CΪO2��BΪNaOH��D�����ᷴӦ��������Ӧ���ɵ�EΪFeCl2��B��E��Ӧ����HΪFe��OH��2��H�볱ʪ�Ŀ�����Ӧ���ɵ�MΪFe��OH��3��M�����ᷴӦ���ɵ�WΪFeCl3��C��F����ɫ��ζ�����壬��������������Ӧ���ɵ�FΪH2���ݴ˴��⡣
��1����������ķ�����֪��DΪFe3O4��EΪFeCl2��
�ʴ�Ϊ��Fe3O4��FeCl2��
��2������FΪH2�������Ϳ��������һ���ķ�Χ�ڵ�ȼ�ᷢ����ը����ȼH2ǰ�����ȼ������崿�ȣ�
�ʴ�Ϊ���������崿�ȣ�
��3��Fe��OH��2�ڳ�ʪ�����б��Fe��OH��3��ʵ������Ϊ����ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��3+O2+2H2O=4Fe��OH��3���ʴ�Ϊ����ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��4Fe��OH��3+O2+2H2O=4Fe��OH��3��
��4��NaOH��Al��Ӧ����H2�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2�����ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����

����Ŀ�� �ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��Ʊ�����������ͼ��ʾ���ش��������⣺
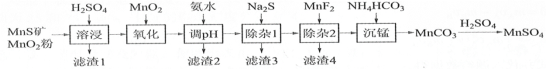
��ؽ�������[c0(Mn+)=0.1 mol��L1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
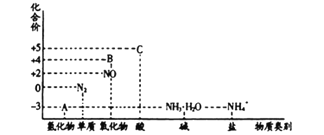
��1��������1������S��________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ_______��
��2����������������������MnO2�������ǽ�________________________��
��3������pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
��4��������1����Ŀ���dz�ȥZn2+��Ni2+��������3������Ҫ�ɷ���______________��
��5��������2����Ŀ��������MgF2������ȥMg2+������Һ��ȹ��ߣ�Mg2+��������ȫ��ԭ����______
��6��д���������������ӷ���ʽ_____________________________________��
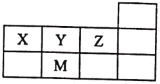
����Ŀ����ͼ�ý�����෨��ʾ��һЩ���ʻ����֮��Ĵ����������ϵ������ȷ����( )
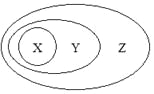
X | Y | Z | |
A | CuSO4��5H2O | �� | ������ |
B | ���� | ��ɢϵ | ����� |
C | ���������� | ������ | ������ |
D | �û���Ӧ | ������ԭ��Ӧ | ���ӷ�Ӧ |
A.AB.BC.CD.D