题目内容
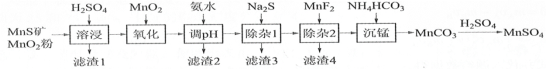
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
【答案】SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 NiS和ZnS F与H+结合形成弱电解质HF,MgF2(s)Mg2++2F平衡向右移动 Mn2++2![]() =MnCO3↓+CO2↑+H2O
=MnCO3↓+CO2↑+H2O
【解析】
硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素),MnS矿和MnO2粉加入稀硫酸,MnO2具有氧化性,二者发生氧化还原反应生成MnSO4、S,同时溶液中还有难溶性的SiO2及难溶性的硅酸盐,所以得到的滤渣1为SiO2和S和难溶性的硅酸盐;然后向滤液中加入MnO2,将还原性离子Fe2+氧化生成Fe3+,再向溶液中加入氨水调节溶液的pH除铁和铝,所以滤渣2为Fe(OH)3、Al(OH)3;根据流程图,结合表格数据,加入的Na2S和Zn2+、Ni2+反应生成硫化物沉淀,“除杂1”的目的是除去Zn2+和Ni2+,所以滤渣3为NiS和ZnS;“除杂2”的目的是生成MgF2沉淀除去Mg2+,所以滤渣4为MgF2,最后向滤液中加入碳酸氢铵得到MnCO3沉淀,用稀硫酸溶解沉淀MnCO3得到硫酸锰,据此分析解答。
(1)根据上述分析,“滤渣1”含有S和难溶性的二氧化硅或硅酸盐;“溶浸”中二氧化锰与硫化锰发生氧化还原反应生成锰离子、S和水,离子方程式为MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,故答案为:SiO2(不溶性硅酸盐);MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(2)MnO2具有氧化性,能氧化还原性离子Fe2+生成Fe3+,从而在调节pH时除去这两种离子,故答案为:将Fe2+氧化为Fe3+;
(3)“调pH”除铁和铝,溶液的pH应该大于这两种离子完全沉淀所需pH且小于其它离子生成沉淀的pH值,在pH=4.7时Fe3+和Al3+沉淀完全,在pH=6.2时Zn2+开始产生沉淀,为了只得到氢氧化铝和氢氧化铁沉淀,需要溶液的pH范围为4.7~6之间,故答案为:4.7;
(4)“除杂1”的目的是除去Zn2+和Ni2+,这两种离子和硫离子生成硫化物沉淀,所以滤渣3为NiS和ZnS,故答案为:NiS和ZnS;
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+,溶液中存在MgF2的溶解平衡,如果溶液酸性较强,生成弱电解质HF而促进氟化镁溶解,即F-与H+结合形成弱电解质HF,MgF2(s)Mg2++2F-平衡向右移动,所以镁离子沉淀不完全,故答案为:F-与H+结合形成弱电解质HF,MgF2(s)Mg2++2F-平衡向右移动;
(6)“沉锰”时锰离子和碳酸氢根离子反应生成碳酸锰沉淀,同时还生成水、二氧化碳,离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。