题目内容
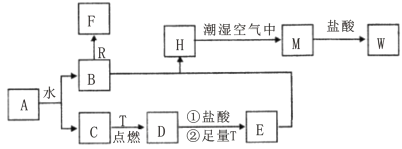
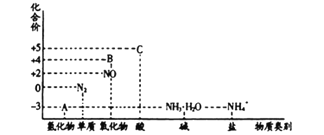
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价——物质类别关系图如下。
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:__________
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式: _______________;
(3)实验室中,检验溶液中含有NH4+的操作方法是: __________________________;
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式_____________,当反应消耗3.36L (标准状况) 物质B时,转移电子的物质的量为__________________________。
(5)将32g铜与140 mL一定浓度的C溶液反应,铜完全溶解产生的气体在标准状况下的体积为11.2L。
①参加反应的C的物质的量为__________________________;
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原C溶液的浓度为________ mol·L-1
③欲使铜与C反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通入O2_____mol。
【答案】4NH3+5O2 ![]() 4NO+6H2O C+4HNO3(浓)
4NO+6H2O C+4HNO3(浓)![]() CO2+4NO2+2H2O 取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH4+ 3NO2+H2O=2H++2NO3﹣+NO 0.1mol 1.5mol
CO2+4NO2+2H2O 取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH4+ 3NO2+H2O=2H++2NO3﹣+NO 0.1mol 1.5mol ![]() 0.5
0.5
【解析】
根据氮元素化合价——物质类别关系分析,A为氨气,B为二氧化氮,C为硝酸,
(1)在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水;
(2)在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水;
(3)铵根离子结合氢氧根离子受热条件下反应生成氨气,遇到湿润的红色石蕊试纸变蓝;
(4)物质B为红棕色气体为NO2,二氧化氮和水反应生成硝酸和一氧化氮,结合元素化合价变化计算电子转移总数;
(5)①根据硝酸铜的化学式,和N原子守恒,求出参加反应的硝酸的物质的量;
②根据硝酸根离子守恒求出起酸作用的硝酸物质的量,根据N原子守恒求出作氧化剂的硝酸的物质的量,进而求出硝酸的物质的量浓度;
③分别求出混合气体中NO和NO2的物质的量,根据电子得失守恒求解。
氮元素化合价一物质类别关系分析,A为氨气,B为二氧化氮,C为硝酸,
(1)在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓)![]() CO2+4NO2+2H2O,故答案为:C+4HNO3(浓)
CO2+4NO2+2H2O,故答案为:C+4HNO3(浓)![]() CO2+4NO2+2H2O;
CO2+4NO2+2H2O;
(3)实验室中,检验溶液中含有NH4+的操作方法是:取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH4+,故答案为:取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH4+;
(4)物质B为红棕色气体为NO2,二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:3NO2+H2O=2H++2NO3﹣+NO,反应中氮元素化合价+4价变化为+5价和+2价,3mol二氧化氮反应电子转移总数2mol,当反应消耗3.36L (标准状况) 物质B时,物质的量=![]() =0.15mol,转移电子的物质的量为
=0.15mol,转移电子的物质的量为![]() =0.1mol,故答案为:3NO2+H2O=2H++2NO3﹣+NO;0.1mol;
=0.1mol,故答案为:3NO2+H2O=2H++2NO3﹣+NO;0.1mol;
(5)①32g铜的物质的量为![]() =0.5mol,标准状况下的体积为11.2L的气体物质的量为
=0.5mol,标准状况下的体积为11.2L的气体物质的量为![]() =0.5mol,根据硝酸铜的化学式,起酸作用的硝酸物质的量为2
=0.5mol,根据硝酸铜的化学式,起酸作用的硝酸物质的量为2![]() 0.5mol=1mol,根据N原子守恒,作氧化剂的硝酸的物质的量为0.5mol,所以参加反应的硝酸的物质的量为1mol+0.5mol=1.5mol;故答案为:1.5mol;
0.5mol=1mol,根据N原子守恒,作氧化剂的硝酸的物质的量为0.5mol,所以参加反应的硝酸的物质的量为1mol+0.5mol=1.5mol;故答案为:1.5mol;
②将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得,起酸作用的硝酸物质的量=0.001aVmol,根据N原子守恒,作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度=![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
③设混合气体中NO和NO2的物质的量分别为xmol、ymol,则x+y=0.5,3x+y=0.5![]() 2,解得x=0.25,y=0.25。设需要O2的物质的量为zmol,根据电子得失守恒得:0.25
2,解得x=0.25,y=0.25。设需要O2的物质的量为zmol,根据电子得失守恒得:0.25![]() 3+0.25
3+0.25![]() 1+0.5
1+0.5![]() 2=4z,解得z=0.5。故答案为:0.5。
2=4z,解得z=0.5。故答案为:0.5。